Апластична анемія (АА)
1 Що таке Апластична анемія?
2 Симптоми
3 Діагностика
4 Клінічний курс
5 Терапія
6 Прогноз
7 Реєстрів
1 Що таке Апластична анемія?
1.1 Загальна інформація
Апластична анемія – це доброякісне гематологічне захворювання. В основі лежить порушення функції кісткового мозку, що призводить до зменшення утворення клітин крові.
Залежно від причини виникнення апластичної анемії розрізняють вроджені (наприклад, анемія Даймонда-Блекфана або Фанконі, теломеропатії) та набуті форми. Обидві форми можуть виникати в будь-якому віці.
Порушення кровотворення після хіміо- або променевої терапії не є апластичною анемією.
1.2 Поширеність (епідеміологія)
Захворюваність на апластичну анемію в Центральній Європі становить 2-3 нових випадки на 1 мільйон населення на рік. Це робить апластичну анемію дуже рідкісним захворюванням. Більшість людей хворіють у віці від 10 до 25 років і старше 60 років, причому представники обох статей хворіють однаково часто.
1.3 Розвиток (патогенез)
Згідно з дослідженнями, при набутій апластичній анемії частина власної імунної системи пацієнта атакує клітини кісткового мозку. Це підтип лімфоцитів, який перешкоджає утворенню нових клітин крові через цей аутоімунний процес. У деяких випадках причиною набутої апластичної анемії можуть бути ліки або токсичні речовини (близько 20 %) або вірусна інфекція (близько 5 %).
Однак у більшості випадків набутої апластичної анемії (близько 75 %) причину розвитку захворювання встановити не вдається, тому походження хвороби залишається нез’ясованим (ідіопатичним). Однак існують також випадки, коли вроджені зміни є причиною виникнення або прогресування апластичної анемії.
Нещодавні дослідження показують, що відповідна частка пацієнтів з очевидно набутою апластичною анемією страждає на вроджену форму, яка стає клінічно очевидною лише на пізній стадії. В даний час частка вроджених випадків, які розпізнаються лише в дорослому віці, становить 5-15% від усіх апластичних анемій у дорослих. Можна припустити, що ця частка буде продовжувати зростати в результаті покращення можливостей обстеження. Це важливо, оскільки рекомендації щодо лікування цієї групи пацієнтів відрізняються від випадків набутої апластичної анемії. Це особливо важливо щодо трансплантації стовбурових клітин.
1.4 Діагностичні критерії та класифікація
Для того, щоб захворювання вважалося апластичною анемією, необхідно відповідати наступним критеріям:
- Кількість клітин у кістковому мозку (клітинність) становить менше 25 % порівняно зі здоровим кістковим мозком, при цьому оцінка ґрунтується на біопсії кісткового мозку. В рамках захворювання виробництво клітин може бути зниженим (гіпопластичним) або повністю відсутнім (апластичним).
- Зменшення двох (біцитопенія) або трьох клітинних рядів (три- або панцитопенія) різного ступеня в мазку крові.
- Немає доказів (пере)утворення сполучної тканини в кістковому мозку (фіброзу) або ураження кісткового мозку злоякісними або чужорідними клітинами кісткового мозку.
- Крім того, не повинно бути значних клітинних змін (дисплазії) у кровотворенні.
- Останнім часом не проводилася променева або хіміотерапія, яка могла б пояснити порушення функції кісткового мозку (недостатність кісткового мозку).
- Контакту з радіоактивним випромінюванням не було.
Класифікація апластичної анемії базується на показниках крові (див. таблицю нижче):
- нетяжка апластична анемія = нАА (“нетяжка АА”)/помірно тяжка апластична анемія (“помірна АА”)
- важка апластична анемія = SAA (“важка АА”)
- Дуже важка апластична анемія = vSAA (“дуже важка АА”)
і має вирішальне значення для прогнозу та лікування.
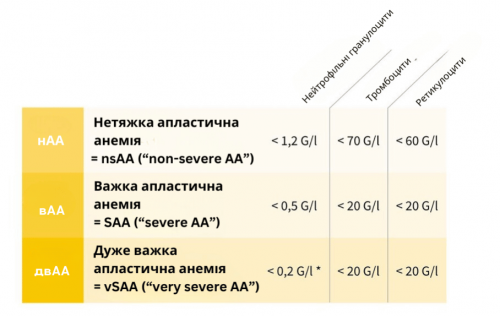
Класифікація апластичної анемії ґрунтується на аналізі крові (загальний аналіз і мазок). Повинні бути виконані два з трьох критеріїв. *Для класифікації як двАА має бути виконаний критерій гранулоцитів < 0,2 Г/л.
2 Симптоми
2.1 Анемія
Зменшення кількості червоних кров’яних тілець (еритроцитів), що переносять кисень, може викликати слабкість, втому, задишку і навіть прискорене серцебиття, особливо під час фізичних навантажень. Крім того, у пацієнтів з анемією часто спостерігається блідість, особливо долонь, хоча наявність блідості не слід сприймати як свідчення анемії.
2.2 Підвищена сприйнятливість до інфекцій
Зменшення кількості білих кров’яних тілець (лейкоцитів) підвищує ризик інфікування організму. Оскільки власна захисна система організму не функціонує належним чином при зниженій кількості нейтрофільних гранулоцитів, підтипу білих кров’яних тілець, така інфекція може набути загрозливого для життя перебігу протягом декількох годин і призвести до зараження крові.
Тому важливо негайно повідомити лікаря, якщо у вас підвищилася температура. Лихоманка визначається як температура тіла понад 38 °C, виміряна двічі протягом однієї години у вусі, або понад 38,3 °C, виміряна одноразово у вусі.
2.3 Кровотеча
Якщо кількість тромбоцитів зменшується, може порушуватися гемостаз. Це призводить до кровоточивості ясен і так званих петехій, невеликих точкових крововиливів у шкіру або синців (гематом). Вони також можуть виникати спонтанно, тобто без попередньої травми. При порушенні гемостазу навіть відносно незначна кровотеча або травма (наприклад, при відвідуванні стоматолога) може стати небезпечною. Тому у випадку кровотечі також слід негайно звернутися до лікаря, щоб він вирішив, чи потрібні спеціальні заходи (наприклад, переливання тромбоцитів).
3 Діагностика
За наявності однієї або декількох з перерахованих вище скарг і симптомів сімейний лікар призначить аналіз крові. Якщо аналіз крові виявить відхилення від норми, пацієнта слід направити до спеціаліста з гематології та онкології.
Там проводиться низка подальших досліджень:
- Історія хвороби (анамнез), в тому числі сім’ї, включаючи детальний запис про прийняті ліки
- Фізичне обстеження, наприклад, ознаки анемії та кровотечі
- Клітинні аналізи
-
- мікроскопічний диференційний аналіз крові
- Ретикулоцити
- Діагностика ПНГ (пароксизмальна нічна гемоглобінурія) (відповідна кількість клітин ПНГ може бути виявлена у 70 % випадків АА), див. ПНГ, 3 Діагностика
- Клінічна хімія
-
- Показники гемолізу: зокрема ЛДГ, гаптоглобін, білірубін
- Коагуляція: швидке значення, ПЧТЧ, фібриноген
- Показники функції печінки: АСТ, АЛТ та АП
- Показники функції нирок: Креатинін, сечова кислота
- Рівень цукру в крові
- Загальний білок, електрофорез, імуноглобуліни
- Параметр запалення СРБ
- Рівень вітаміну В12 та фолієвої кислоти
- Статус заліза: феритин. Якщо значення феритину > 1000 нг/мл, подальше уточнення можливого ураження органів через перевантаження залізом
- Вірусна діагностика: гепатити A, B, C; ВІЛ, EBV, CMV, парвовірус B19
- Антинуклеарні та анти-ДНК антитіла
- Функціональна діагностика
-
- Ультразвукове дослідження серця та верхньої частини черевної порожнини (сонографія)
- Рентгенологічне дослідження органів грудної клітки (грудної клітки)
- ЕКГ
- Спеціальні аналізи
- HLA-типування пацієнта та його братів і сестер
- Визначення довжини теломер
- При підозрі на “вроджений” синдром недостатності кісткового мозку – подальша діагностика, наприклад, аналіз хромосомних розривів при підозрі на анемію Фанконі, генетичні тести.
-
-
-
Якщо підтверджено зменшення кількості однієї або декількох клітинних ліній крові без відомої причини підвищеного споживання або розпаду цих клітин крові, необхідно терміново провести обстеження кісткового мозку. Таким чином можна визначити, чи є порушення кровотворення або інша причина.
Це передбачає пункцію кісткового мозку, яка може бути виконана в амбулаторних умовах. Кістковий циліндр (біопсія кісткового мозку, пункція кісткового мозку) береться у пацієнта під місцевою анестезією за допомогою порожнистої голки (голки Джамшиді), зазвичай з тазової кістки. Зразок довжиною приблизно 1,5 см і діаметром 2-3 мм аналізується та оцінюється мікроскопічно (гістологічно).
Крім того, отримують кров, кістковий і жировий мозок (аспірація кісткового мозку), які розкладають на предметному склі, висушують, фарбують, а також оцінюють під мікроскопом в цілому або в їх положенні по відношенню один до одного (цитологічне дослідження).
Крім того, можуть бути проведені генетичні дослідження клітин кісткового мозку, результати яких можуть, наприклад, полегшити диференціацію захворювання від інших хвороб.
Оскільки окремі лабораторні етапи виготовлення гістології кісткового мозку займають багато часу, до отримання повного результату проходить приблизно 1-2 тижні. Якщо спостерігається знижене утворення двох або трьох клітинних рядів (еритроцитів, лейкоцитів, тромбоцитів) відповідно до діагностичних критеріїв без одночасної присутності патологічно змінених клітин (наприклад, лейкозних клітин) і без попереднього проведення хіміо- або променевої терапії, це називається апластичною анемією.
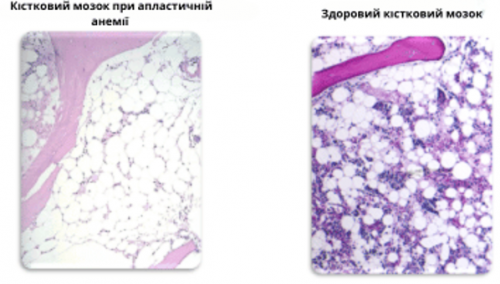
Дослідження кісткового мозку пацієнта з апластичною анемією у порівнянні зі здоровим кістковим мозком. У хворому кістковому мозку можна розпізнати переважно сполучну тканину та жирові клітини. У здоровому кістковому мозку клітини крові виділяються у вигляді різнокольорових маленьких крапок на тлі великих білих жирових клітин.
Метою цих численних досліджень є
- виключити інші захворювання,
- з’ясувати можливі причини (етіологію),
- для визначення ступеня тяжкості апластичної анемії,
- для визначення прогнозу.
Пацієнтам з дуже тяжкою та тяжкою апластичною анемією віком до 50 років, які перебувають у хорошій фізичній формі, має сенс провести HLA-типування пацієнта відразу після встановлення діагнозу. Якщо є рідні брати і сестри, їм також слід провести типування, щоб визначити їх придатність для донорства стовбурових клітин.
4 Прогресія
Без специфічної терапії апластична анемія у дорослих призводить до летального результату у 70% випадків.
Існує ймовірність того, що апластична анемія може перерости в мієлодиспластичний синдром (МДС) або гострий мієлоїдний лейкоз (ГМЛ). Крім того, деякі пацієнти з АА мають мутацію, специфічну для ПНГ, а це означає, що симптоми і потреба в лікуванні пароксизмальної нічної гемоглобінурії (ПНГ) також можуть стати актуальними.
5 Терапія
5.1 Загальний огляд
Спонтанне гематологічне загоєння (спонтанна ремісія) практично ніколи не відбувається при тяжкій недостатності кісткового мозку.
Лікування необхідне при
- Дуже тяжка (vSAA) та тяжка апластична анемія (SAA)
- Нетяжка апластична анемія (нАА) зі значним зменшенням принаймні однієї клітинної лінії (цитопенія), що вимагає регулярних переливань або призводить до ризику інфекції чи кровотечі
Хоча кілька десятиліть тому шансів на вилікування або довготривале поліпшення стану було мало, зараз існують багатообіцяючі варіанти. Існує два основних варіанти лікування: імуносупресивна терапія (ІСТ) та трансплантація стовбурових клітин (ТСК) або трансплантація кісткового мозку (ТКМ). Крім того, існують спеціальні методи лікування для певних підгруп пацієнтів. Який з них підійде конкретному пацієнту, залежить від тяжкості захворювання, віку пацієнта і можливих супутніх захворювань, а також від ступеня так званої HLA-сумісності зі спорідненим або неспорідненим потенційним донором кісткового мозку.
Якщо є показання до терапії, лікування слід розпочати якомога швидше, щоб запобігти прогресуванню захворювання та його можливим ускладненням (наприклад, тяжкій анемії, інфекціям, кровотечам і порушенням згортання крові). Тому важливим є раннє планування лікування у співпраці зі спеціалізованим центром.
Курс лікування пацієнтів з дуже тяжкою та тяжкою апластичною анемією показаний на наступній схемі.
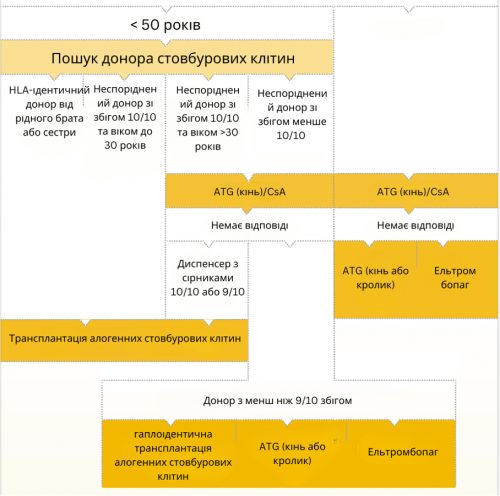
Наочне спрощене представлення алгоритму терапії. Повний алгоритм проілюстровано в настановах DGHO на Onkopedia
5.2 Імуносупресивна терапія (ІСТ)
Антитимоцитарний глобулін (ATG) та циклоспорин (CsA)
Оскільки при набутій апластичній анемії власна імунна система організму обертається проти власного кісткового мозку, часто показана імуносупресивна терапія, особливо пацієнтам з набутою апластичною анемією:
- Пацієнти з vSAA або SAA> 50 років
- Пацієнти без HLA-ідентичних (рідних) донорів
- Пацієнти з vSAA або SAA віком до 50 років у поганому фізичному стані
- Пацієнти з нSAA/SAA з ризиком тяжкої цитопенії принаймні в одній клітинній лінії
Імуносупресивна терапія зазвичай включає комбінацію препаратів антитимоцитарного глобуліну та циклоспорину. Це дозволяє кістковому мозку відновитися. Під час терапії зазвичай спостерігається короткочасне погіршення показників аналізу крові, перш ніж настає покращення.
АТГ – це антитіло, яке знищує гіперактивні Т-лімфоцити, що ушкоджують кістковий мозок. Зазвичай АТГ вводять протягом 4-5 днів у вигляді інфузії у велику вену через центральний венозний катетер (ЦВК). Під час терапії АТГ рівень тромбоцитів слід підвищувати або підтримувати на рівні 30 Г/л за допомогою переливання тромбоцитів, якщо це необхідно, оскільки під час терапії може відбутися швидке зниження рівня тромбоцитів. Під час терапії АТГ слід очікувати перебування в стаціонарі протягом приблизно 1-2 тижнів. Побічні ефекти терапії АТГ можуть включати алергічні реакції, такі як шкірні висипання та лихоманка. Для пригнічення гострих побічних ефектів АТГ також призначають кортизонові препарати, наприклад, преднізон або преднізолон, протягом короткого періоду часу. Існує також підвищений ризик розвитку певних патогенних мікроорганізмів, тому необхідно вживати запобіжних заходів у зв’язку з цим.
Циклоспорин, який пригнічує вивільнення імуностимулюючих речовин, є ще одним ключовим фактором відповіді захворювання на терапію. У випадку CsA проводяться регулярні лабораторні перевірки для досягнення оптимального ефекту шляхом коригування дози, якщо це необхідно. Метою є досягнення коридорного рівня 170-225 нг/мл в крові. Для забезпечення стабільного рівня ефективності препарат слід приймати дуже регулярно з фіксованими інтервалами в 12 годин.
Можливі побічні ефекти терапії CsA включають інфекції, погіршення функції нирок, підвищення артеріального тиску, розростання ясен (гіперплазія ясен), посилений ріст волосся, м’язові судоми, порушення чутливості або тремтіння. Побічні ефекти залежать від дози і зазвичай зникають після припинення терапії CsA.
CsA приймають у вигляді капсул або соку протягом щонайменше 12 місяців. Якщо відповідь на терапію дуже добра і стабільна, важливо дуже повільно і поступово знижувати дозу CsA, щоб уникнути рецидиву захворювання. Однак деяким пацієнтам для підтримання успіху терапії необхідно приймати CsA довше або постійно.
Інтенсивна імуносупресивна терапія дозволяє досягти одужання (повна ремісія, ПР) або принаймні значного поліпшення (часткова ремісія, ЧР) приблизно у 50-75% пацієнтів, з незалежністю від переливання крові та значним зниженням ризику інфікування і кровотечі. Для покращення показників крові потрібно близько 2-4 місяців, у деяких пацієнтів навіть 6 місяців. Метою є припинення клінічних симптомів та ризиків. Це не вимагає повної нормалізації показників крові, яка часто не досягається.
Якщо відповіді немає, через 4-6 місяців можна розглянути можливість повторної імуносупресивної терапії.
У разі рецидиву також можна повторити імуносупресивну терапію, оскільки ймовірність повторної відповіді становить 30-60%.
Окрім специфічної терапії, кожен пацієнт повинен отримувати так звану підтримуючу терапію.
Алемтузумаб
Існують також інші препарати, які працюють за тим самим імуносупресивним механізмом. До них належить, наприклад, алемтузумаб – антитіло, яке діє проти Т-лімфоцитів. Цей препарат застосовується при хронічній лімфоцитарній лейкемії (ХЛЛ) або розсіяному склерозі (РС), але також показав хороші результати в дослідженнях апластичної анемії, особливо у літніх пацієнтів. Однією з переваг цього препарату є те, що він вводиться тільки під шкіру, тому госпіталізація не потрібна. Якщо пацієнт раніше мав інфекцію цитомегаловірусу (ЦМВ), рівень цього вірусу в крові слід регулярно перевіряти, оскільки ця вірусна інфекція може рецидивувати під час лікування.
Пацієнти, у яких інші види терапії були неефективними, продемонстрували частоту відповіді на лікування алемтузумабом 37-48%.
5.3 Алогенна трансплантація
У пацієнтів віком до 50 років (важливим є загальний стан, “біологічний вік”) з тяжкою або дуже тяжкою апластичною анемією (SAA або vSAA) та наявністю донора-родича, який повністю відповідає структурам тканинної сумісності (HLA) пацієнта (HLA-ідентичний), кращим методом лікування (терапія першої лінії) є алогенна трансплантація.
Пацієнти віком до 30 років також можуть отримати стовбурові клітини від неспорідненого HLA-ідентичного донора (неродинного донора), якщо у них немає HLA-ідентичного сімейного донора. Важливо, щоб було проведено так зване тонке типування (не менше 10 HLA-антигенів) і щоб донор і реципієнт були повністю ідентичні.
В останні роки частота ускладнень при HLA-ідентичній трансплантації від неродинного донора значно знизилася. Тому трансплантація HLA-ідентичного неродинного донора все частіше застосовується для пацієнтів молодше 50 років, які не відповіли на імуносупресивну терапію.
Метою алогенної трансплантації є заміна нефункціонуючого кісткового мозку пацієнта здоровими стовбуровими клітинами донора. Для цього кістковий мозок пацієнта спочатку руйнується за допомогою різних заходів (хіміотерапія, терапія антитілами, променева терапія). Це так зване кондиціонування проводиться в дні, що передують трансплантації.
У цей же час від здорового, родинного або неродинного добровільного донора збирають нові, здорові стовбурові клітини.
Стовбурові клітини можна отримати безпосередньо з кісткового мозку за допомогою біопсії кісткового мозку під анестезією. Проколи в клубовій кістці для забору кісткового мозку можуть викликати синці та біль, які триватимуть кілька днів. Існує також загальний ризик анестезії.
Або ж через кілька днів донору вводять препарат, що стимулює утворення гранулоцитів (Г-КСФ). В результаті збільшення кількості гемопоетичних стовбурових клітин вони мігрують з кісткового мозку в кров. Ці так звані периферичні стовбурові клітини крові (ПСКК) потім збираються за допомогою спеціального пристрою (аферезу), як при донорстві плазми крові. Процедура може викликати грипоподібні симптоми та біль.
Якщо стовбурові клітини отримують безпосередньо з кісткового мозку, це називається трансплантацією кісткового мозку (ТКМ); якщо стовбурові клітини отримують шляхом аферезу, це називається трансплантацією стовбурових клітин (ТСК).
Дослідження показують, що лікування апластичної анемії стовбуровими клітинами з периферичної крові може бути пов’язане з підвищеним ризиком ускладнень, таких як гострі або хронічні реакції відторгнення. Тому, якщо можливо, слід використовувати стовбурові клітини, отримані безпосередньо з кісткового мозку.
Незалежно від того, як були отримані стовбурові клітини, їх очищають і аналізують на наявність інфекційних агентів. Потім пацієнт отримує донорські стовбурові клітини. Сама трансплантація відбувається як переливання крові. Якщо все йде добре, донорські стовбурові клітини “ростуть” і призводять до нормальної роботи кісткового мозку і кровотворення. Для трансплантації необхідне перебування в стаціонарі не менше 4 тижнів.
Під час трансплантації пацієнт отримує ліки для запобігання (профілактики) інфекцій, спричинених бактеріями та грибками. Крім того, протягом декількох місяців вводять кортизоновий препарат, наприклад, преднізолон, і циклоспорин (CsA) для впливу на імунну систему.
Можливі ускладнення після трансплантації
- Токсичні побічні ефекти під час кондиціонуючої терапії
- Інфекції
- Хвороба “трансплантат проти хазяїна” (GvHD)
- Відторгнення трансплантата
Хвороба “трансплантат проти хазяїна” (GvHD): у цьому випадку донорська імунна система реагує проти власних клітин організму. Це може бути короткочасною (гострою) або більш пізньою і тривалою (хронічною) реакцією, що означає необхідність постійного пригнічення імунної системи (імуносупресивна терапія).
5.4 Подальші варіанти терапії
Даназол
Деякі пацієнти з апластичною анемією мають рідкісне вроджене захворювання, при якому кінці хромосом (теломери) вкорочені, що називається теломеропатією. Вкорочення теломер призводить до порушення поділу клітин і, як наслідок, до зменшення утворення клітин крові в кістковому мозку.
Даназол, синтетичний варіант чоловічого статевого гормону тестостерону, подовжує теломери, що може призвести до покращення симптомів і навіть нормалізації кровотворення.
Ельтромбопаг (Revolade®)
З 2015 року Ельтромбопаг схвалений для лікування дорослих пацієнтів з набутою тяжкою апластичною анемією (НАА), якщо у них є
- або не відповіли на попередню імуносупресивну терапію, або
- пройшли ретельну попередню обробку та
- не підходять для трансплантації кісткового мозку або стовбурових клітин.
Завдяки дуже високим показникам відповіді в клінічних дослідженнях, Ельтромбопаг вже схвалений в США в комбінації з hATG і CsA для лікування апластичної анемії в першій лінії терапії. В ЄС дозволу для лікування першої лінії немає. Однак, зважаючи на його доведену ефективність, Німецьке товариство гематології та медичної онкології рекомендує використовувати Ельтромбопаг у першій лінії лікування набутої SAA/vSAA в рамках своїх рекомендацій.
Ельтромбопаг впливає на контроль утворення стовбурових клітин крові та тромбоцитів. Препарат активує тромбопоетин, який контролює утворення тромбоцитів і крові (кровотворення). Ефективна доза для SAA становить
150 мг/добу. Було показано, що застосування Ельтромбопагу призводить до покращення показників тромбоцитів, еритроцитів та нейтрофілів у більшості пацієнтів. Ельтромбопаг також призводив до покращення або нормалізації клітинності кісткового мозку. У пацієнтів, які раніше потребували регулярних переливань крові, збільшилася кількість днів до наступного переливання або вони стали трансфузійно-незалежними.
Різне
Слід уникати терапії без доведеної ефективності, наприклад, монотерапії стероїдами або монотерапії гемопоетичними факторами росту, оскільки вона означає лише втрату часу і може значно погіршити початкову ситуацію пацієнта щодо одного з доведених варіантів терапії.
5.5 Підтримуюча терапія
Профілактика та лікування інфекцій, уникнення кровотеч, індивідуальна стратегія переливання крові та лікування перевантаження залізом мають особливе значення у підтримуючій терапії. Ці заходи були вдосконалені в останні роки і сприяють підвищенню ймовірності виживання, навіть якщо лікування не дає повної відповіді.
Інфекції
У разі лихоманки слід якомога швидше звернутися до лікаря, щоб поставити діагноз і почати лікування.
У деяких випадках може бути корисним профілактичне застосування антибіотиків проти бактерій і протигрибкових препаратів проти грибків.
- У пацієнтів з тяжкою нейтропенією (кількість гранулоцитів/нейтрофілів < 0,5 Г/л)
- Пацієнтам, які отримують терапію антитимоцитарним глобуліном (АТГ) або алемтузумабом, слід проводити додаткову профілактику проти інших збудників (наприклад, Pneumocystis jirovecii, цитомегаловірус).
Крім того, якщо кількість гранулоцитів/нейтрофілів низька (< 0,5 Г/л), слід дотримуватися різних поведінкових заходів:
- Уникайте контакту з людьми, які страждають на інфекції
- Уникайте тісного фізичного контакту з тваринами
- Уникайте великих скупчень людей, особливо в зимові місяці
- Проводьте звичайні гігієнічні заходи, наприклад, миття рук, гігієну порожнини рота, стежте за тим, щоб сира їжа була свіжою та чистою
- Уникайте тісного контакту зі спорами грибків, особливо в саду, не чистіть контейнери для органічних відходів і не перевертайте компост
У дуже рідкісних випадках, наприклад, при важких інфекціях, може бути розглянуто застосування гемопоетичних факторів росту G-CSF або GM-CSF для стимуляції власного імунного захисту організму або переливання концентратів лейкоцитів (гранулоцитарних концентратів).
Додаткову інформацію можна знайти в брошурі “Інфекції? Ні, дякую!” М. Екснер та А. Сімон з Німецького фонду допомоги хворим на лейкемію та лімфому.
Кровотеча
Через знижену кількість тромбоцитів у пацієнтів з апластичною анемією можуть виникати сильні, навіть небезпечні для життя кровотечі. Підвищена або тривала кровотеча може виникнути під час травм або операцій, а також раптова кровотеча без видимої причини.
Це робить ще більш важливим не обмежувати функцію наявних тромбоцитів за допомогою ліків. До таких препаратів належать інгібітори агрегації тромбоцитів, оскільки вони запобігають злипанню тромбоцитів і, таким чином, перешкоджають гемостазу. Тому застосування інгібіторів агрегації тромбоцитів, таких як ацетилсаліцилова кислота (АСК), є надзвичайно важливим, особливо у випадку дуже низької кількості тромбоцитів, і має бути ретельно зваженим.
У жінок з рясними менструальними кровотечами менструальну кровотечу також можна тимчасово зупинити за допомогою гормональної терапії, наприклад, безперервного прийому таблеток або 3-місячних ін’єкцій, щоб запобігти надмірній втраті крові в разі наявного дефіциту тромбоцитів.
Основним засобом профілактики крововиливів і лікування вже наявних кровотеч є переливання тромбоцитарних концентратів.
Переливання крові (трансфузії)
Переливання крові необхідне багатьом пацієнтам для забезпечення достатньої фізичної стійкості та якості життя, а також для запобігання ускладнень, пов’язаних з кровотечею. Вони можуть тимчасово замінити відсутні клітини крові у разі виникнення відповідних симптомів (анемія, кровотеча). Переливається не вся кров, а лише той тип клітин, який необхідний (еритроцити або тромбоцити).
Для виробництва концентрату кров після донації спочатку аналізують, щоб виключити інфекції, що передаються, потім видаляють лейкоцити, відокремлюють і концентрують різні компоненти крові. Членам сім’ї не дозволяється здавати кров, оскільки ці так звані цільові донації несуть у собі особливі ризики.
Переливання еритроцитів/еритроцитарних концентратів (переливання ЕК)
Щоб забезпечити хорошу сумісність, використовуваний препарат не тільки підбирається відповідно до групи крові (A, B, AB, 0) і резус-фактора, але кожен окремий препарат тестується індивідуально для кожного пацієнта. Для цього кров пацієнта змішується з кров’ю з еритроцитарного концентрату (ЕК) і аналізується в тесті на сумісність, так званому крос-матч. Пошук відповідного концентрату еритроцитів може зайняти більше часу, особливо якщо присутні антитіла. Якщо у пацієнта відсутній цитомегаловірус (ЦМВ) і є можливість подальшої трансплантації кісткового мозку або стовбурових клітин, слід застосовувати ЦМВ-негативні концентрати.
Еритроцитарні концентрати, як правило, слід застосовувати з обережністю, оскільки вони можуть призвести до перевантаження організму залізом. Показаннями до переливання є
- Виражене зниження працездатності в поєднанні з втомою або в контексті задишки, наприклад, під час фізичних навантажень, а також залежно від відповідних супутніх захворювань, наприклад, серцевої недостатності.
- дуже низький рівень гемоглобіну (< 8 г/дл)
Загалом, до трансфузійної терапії відноситься наступне:
Якнайбільше, якнайменше!
Тому показання до переливання повинні бути зважені індивідуально для кожного пацієнта на основі наступних пунктів:
- Клінічні симптоми (наприклад, частота серцевих скорочень, частота дихання, задишка, ознаки кровотечі, лихоманка, інфекції…)
- Суб’єктивні скарги (наприклад, значне зниження працездатності, втома, слабкість, головний біль, шум у
вухах тощо). - Індивідуальні супутні захворювання/історія (наприклад, серцева недостатність, кровотеча)
- Медикаментозне лікування (наприклад, терапія АТГ, хірургічне втручання)
- Можливість моніторингу та короткочасного переливання (амбулаторно/стаціонарно)
Обережна стратегія переливання стосується насамперед пацієнтів, яким планується алогенна трансплантація стовбурових клітин. Якщо планується трансплантація стовбурових клітин, переливання препаратів крові від родичів не повинно відбуватися за жодних обставин.
Переливання тромбоцитів/концентратів тромбоцитів (ТК-трансфузія)
У разі кровотечі можна переливати тромбоцитарні концентрати (ТК), щоб запобігти ускладненням. Оскільки кровотечі з низьким рівнем тромбоцитів можуть бути небезпечними для життя, в таких випадках необхідно вжити негайних заходів. Якщо кількість тромбоцитів дуже низька, з профілактичною метою можна також вводити тромбоцитарні концентрати. Тривалість життя тромбоцитів становить лише кілька днів. Якщо вироблення тромбоцитів у кістковому мозку дуже низьке або відсутнє, може знадобитися введення концентратів тромбоцитів кілька разів на тиждень.
Тромбоцити несуть тканинні характеристики (HLA-маркери), які відрізняються для кожної людини. У деяких пацієнтів виробляються антитіла проти цих HLA-маркерів. Це може статися спонтанно, внаслідок хвороби або після вагітності. За наявності таких HLA-антитіл перелиті тромбоцити негайно руйнуються, і після переливання тромбоцитарного концентрату не відбувається достатнього збільшення кількості тромбоцитів. Для таких пацієнтів необхідно готувати спеціальні HLA-сумісні тромбоцитарні концентрати від донорів з відповідними HLA-характеристиками.
Показання для переливання концентратів тромбоцитів існують:
- з рівнем тромбоцитів < 20 Г/л і лихоманкою > 38°С, інфекціями, ознаками кровотечі або важкою кровотечею в анамнезі (3 або 4 клас ВООЗ), а також алоімунізацією (HLA-антитіла, див. вище)
- Якщо немає ризиків, що підвищують ризик кровотечі (наприклад, лихоманка, інфекції, важкі кровотечі в анамнезі, алоімунізація), переливання можна проводити лише за умови, що кількість тромбоцитів становить < 5 Г/л. Це вимагає регулярного та ретельного моніторингу (наприклад, щонайменше раз на тиждень), відсутності ознак кровотечі (наприклад, петехій) та можливості швидкого переливання у разі появи ознак кровотечі.
- “Індивідуальне граничне значення для пацієнта”: У багатьох пацієнтів є стабільний поріг, нижче якого виникають більш серйозні ознаки кровотечі.
- До і під час терапії АТГ кількість тромбоцитів слід підвищити до 50 Г/л, оскільки під час інфузії АТГ може відбутися швидке падіння рівня тромбоцитів.
- Перед операціями або процедурами слід обов’язково заздалегідь повідомити лікаря про апластичну анемію і, бажано, надати поточний аналіз крові!
Перевантаження залізом
Кожен еритроцитарний концентрат поглинає більш ніж у 100 разів більше заліза, ніж людина отримує щодня з їжею. Оскільки організм людини не може активно виводити залізо, воно відкладається в різних органах, особливо в печінці, серці, нирках і кістковому мозку (див. Таблицю 2), і може пошкоджувати їх. Пацієнти з апластичною анемією або мієлодиспластичним синдромом (МДС) піддаються ризику перевантаження залізом навіть без переливання крові, оскільки погана функція кісткового мозку знижує утворення нових еритроцитів і залізо не може бути повністю використане для утворення нових еритроцитів.
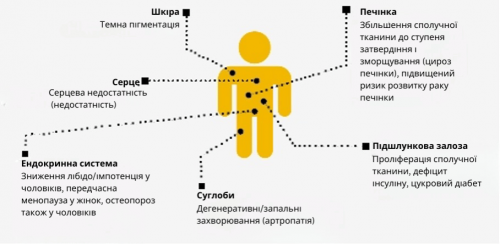
Ускладнення перевантаження залізом
Як правило, рівень накопиченого заліза (феритину) або печінкового заліза, який потребує негайної терапії для зв’язування та виведення надлишку заліза (хелатна терапія), ще не досягнутий протягом перших кількох місяців після встановлення діагнозу. Тому бажано зачекати щонайменше 6 місяців після початку імуносупресії. Хелатотерапія показана при рівні феритину в сироватці крові вище 1 000 мкг/л, якщо зберігається потреба в регулярних переливаннях крові. Це також стосується, зокрема, кандидатів на трансплантацію, оскільки перевантаження залізом асоціюється з вищою смертністю та захворюваністю, пов’язаними з трансплантацією.
Препарати, що використовуються сьогодні для лікування перевантаження залізом, як правило, добре переносяться. Основні побічні ефекти включають нудоту, діарею та порушення функції нирок, які зникають після відміни препарату.
Якщо рівень феритину в сироватці крові нижче 1 000 мкг/л, можна розглянути питання про переривання лікування у разі перевантаження залізом, пов’язаного з трансфузією, залежно від індивідуальних потреб у переливанні крові. Однак це завжди слід робити після консультації з лікарем.
Якщо переливання крові не потрібне, а рівень гемоглобіну достатньо високий, рекомендується флеботомічна терапія (індивідуально, наприклад, невеликими кількостями, наприклад, 100 мл за один збір) як ефективний варіант лікування перевантаження залізом з невеликою кількістю побічних ефектів.
Загалом, перевантаження залізом слід регулярно перевіряти та коригувати терапію.
Додаткову інформацію можна знайти в брошурі “Перевантаження залізом, пов’язане з переливаннямкрові” від Німецького фонду допомоги хворим на лейкемію та лімфому.
Діяльність
Пацієнтам з апластичною анемією рекомендується фізична активність і вправи залежно від показників крові та стану пацієнта. Однак слід подбати про те, щоб не допустити перенапруження. Тому бажано виконувати вправи під контролем пульсу. Це особливо важливо при наявності анемії, оскільки організм часто намагається компенсувати знижену кількість еритроцитів за рахунок збільшення частоти серцевих скорочень, що може призвести до надмірного навантаження на серце. У разі тромбоцитопенії важливо уникати видів спорту, які можуть спричинити травми, наприклад, бойових мистецтв або скелелазіння.
Реабілітація
Якщо участь у “нормальному” житті більше неможлива через апластичну анемію, можуть бути корисними реабілітаційні заходи, амбулаторна фізіотерапія або лікувальна фізкультура чи психологічна або психотерапевтична допомога. Ці заходи повинні бути індивідуально підібрані для пацієнта.
Якщо заплановані заходи інтенсивної терапії, бажано проводити реабілітаційні заходи лише після їх завершення. Фізіотерапія або психологічна чи психотерапевтична підтримка також корисні під час терапії.
При реінтеграції дитини, хворої на апластичну анемію, після завершення імуносупресивної терапії або трансплантації може бути корисним проведення сімейно-орієнтованих заходів у дитячому онкологічному закладі післяопераційного догляду через високе психосоціальне навантаження на сім’ю.
6 Прогноз
Чим вищий рівень гранулоцитів і молодший вік пацієнта на момент встановлення діагнозу, тим кращий прогноз.
Наведені нижче дані про виживання після різних видів лікування є статистичними даними. Це означає, що їх не можна автоматично застосовувати до окремих пацієнтів. Цей список призначений лише для того, щоб дати загальне уявлення про те, як варіанти лікування та виживання покращилися за останні роки. Часто існують підгрупи, які сюди не включені. Для всіх конкретних форм терапії результати для пацієнтів віком до 20 років значно кращі, ніж для пацієнтів старше 20 років. Те саме стосується пацієнтів віком до 40/50 років порівняно з пацієнтами старше 40/50 років. У випадку трансплантації стовбурових клітин результати значно кращі, якщо донор надає стовбурові клітини безпосередньо з кісткового мозку, а не периферичні стовбурові клітини, отримані з крові.
Згідно з опублікованими даними, загальна виживаність при SАА/вSАА становить 3-6 років після різних специфічних форм терапії:
- після алогенної ТСК від HLA-ідентичного сімейного донора 75-90 %
- після алогенної ТСК від HLA-ідентичних неспоріднених донорів 65-73 %
- після терапії ATG/CsA 76-96 %
7 Реєстри
Пацієнти з ознаками клону PNH можуть бути включені в міжнародний реєстр PNH (PNH Registry) через Університетську лікарню Ессена, щоб отримати додаткові знання про цю групу пацієнтів з АА.
Якщо ви зацікавлені або маєте запитання, будь ласка, зв’яжіться з професором Александром Рьотом (alexander.roeth(at)uk-essen.de) електронною поштою.
Пацієнти з теломеропатією можуть бути включені до реєстру AA-BMF в Університетській клініці Аахена, щоб можна було отримати інформацію про цю підгрупу пацієнтів з AА.
Якщо ви зацікавлені або маєте запитання, будь ласка, надішліть електронного листа професору Тіму Х. Брюммендорфу (tbruemmendorf(at)ukaachen.de).

