Пароксизмальна нічна гемоглобінурія (ПНГ)
1 Що таке PNH
2 Симптоми
3 Діагностика
4 Клінічний курс
5 Терапія
6 Прогноз
7 Бажання мати дітей/вагітність
8 Реєстрів
1 Що таке PNH
1.1 Загальна інформація
Як і апластична анемія, пароксизмальна нічна гемоглобінурія (ПНГ) не є злоякісною, але це дуже рідкісне і потенційно небезпечне для життя захворювання. Вона спричинена набутим дефектом кровотворних стовбурових клітин кісткового мозку, який не є спадковим.
1.2 Поширеність (епідеміологія)
Захворюваність становить 1-2 нових випадки на 1 мільйон осіб на рік. Однак через різноманітність симптомів можна припустити, що ПНГ діагностується надто рідко, оскільки його часто не розпізнають. Захворювання найчастіше діагностується у віці від 25 до 45 років, причому представники обох статей хворіють приблизно в рівній кількості. Не існує сімейної кластеризації.
1.3 Розвиток (патогенез)
ПНГ спричинена генетичною зміною (мутацією) в гемопоетичних стовбурових клітинах кісткового мозку. Ця зміна не присутня від народження, а лише розвивається впродовж життя (соматична генна мутація) і не може передаватися нащадкам. Здорові та хворі клітини можуть співіснувати одночасно (мозаїка).
Ця генна мутація, як правило, розташована в певній ділянці генетичного матеріалу – гені PIG-A – і вражає одну або кілька гемопоетичних стовбурових клітин кісткового мозку. Ген виробляє біокаталізатор (фермент), який зазвичай необхідний для виробництва спеціальної якірної системи – глікозилфосфатидилінозитолового якоря (GPI-якоря). Він розташований на клітинній мембрані і використовується для прикріплення численних білків до клітинної мембрани, які, серед іншого, слугують для регулювання імунної системи. Таким чином, вони захищають клітини від нападу специфічної частини імунної системи, так званої системи комплементу, наприклад, маркуючи клітини як чужорідні.
Два з цих білків відіграють особливо важливу роль:
- Фактор прискорення розпаду комплементу (DAF, CD55)
- Протектин (MAC-IP: Membrane Attack Complex Inhibitory Protein, MIRL: Мембранний інгібітор реактивного лізису, CD59)
Зменшення або повна відсутність GPI-зв’язаних білків на клітинній мембрані еритроцитів, лейкоцитів і тромбоцитів робить ці клітини більш сприйнятливими до руйнування системою комплементу. Це призводить до розриву еритроцитів у кровоносних судинах (внутрішньосудинний гемоліз) та активації тромбоцитів, що може призвести до тромбозу.
Система комплементу використовується організмом для захисту від інфекційних агентів, паразитів, чужорідних молекул тощо. Коли вона активується, починається прогресуючий каскадний процес (каскад комплементу), який може закінчитися знищенням клітини-мішені.
2 Симптоми
2.1 Зменшення кількості клітин (цитопенія)
Анемія
Розпад еритроцитів (гемоліз) може призвести до анемії, а отже, до нестачі переносників кисню (гемоглобіну).
Симптоми включають
- Блідість шкіри (неспецифічна ознака)
- Втрата працездатності, відсутність концентрації, депресія, втома, важкість у ногах, швидка втомлюваність
- Задишка (диспное) під час фізичних навантажень через зменшення кількості транспортерів кисню
- Запаморочення, дзвін у вухах, прискорене серцебиття (тахікардія), відчуття стиснення в грудях (стенокардія), порушення зору
Анемія може бути настільки сильною, що стає необхідним переливання еритроцитів (еритроцитарних концентратів).
Подальше зменшення рядів комірок
Окрім еритроцитів, можуть бути знижені й інші формені елементи крові (цитопенія), наприклад, тромбоцити (тромбоцитопенія) або гранулоцити (нейтропенія). Зазвичай це є проявом супутньої апластичної анемії.
2.2 Наслідки гемолізу
Розпад еритроцитів призводить до збільшення вмісту жовчного пігменту білірубіну в крові. Це може призвести до жовтого забарвлення шкіри та білої зовнішньої оболонки очного яблука (склери). Це також називається жовтяницею (icterus або sclerenicterus).
Крім того, гемоглобін вивільняється, коли еритроцити розпадаються. Якщо рівень вільного гемоглобіну дуже високий, він може виводитися через нирки, що призводить до появи темної, червонувато-коричневої або навіть чорної сечі (гемоглобінурія).
Через різні проміжні етапи вільний гемоглобін призводить до зменшення доступності оксиду азоту (NO). Оксид азоту необхідний для розслаблення гладких м’язів, наприклад, у шлунково-кишковому тракті або легенях. Якщо його не вистачає, це призводить до напруження гладких м’язів, що спричиняє судоми, звуження судин і підвищення артеріального тиску, серед іншого.
Цей механізм дії пояснює багато клінічних симптомів ПНГ:
- Сильний, часто кризоподібний біль у животі
- Спазм стравоходу з порушенням ковтання (дисфагія)
- Високий кров’яний тиск
- Високий тиск у легеневому кровообігу (легенева гіпертензія) із задишкою
- Обмеження функції нирок
- Еректильна дисфункція (порушення ерекції)
2.3 Виснаження (втома)
Втома – це неприродно стійка втома або виснаження, що може значно погіршити фізичну та розумову працездатність. Вона характеризується тим, що навіть при збільшенні часу відпочинку або сну не спостерігається або спостерігається лише недостатнє покращення.
Окрім анемії та руйнування еритроцитів, що призводить до нестачі оксиду азоту (NO), можливими причинами втоми є порушення імунної системи або метаболізму.
2.4 Схильність до тромбоутворення (тромбофілія)
Одним з найнебезпечніших наслідків нестачі оксиду азоту є утворення згустків крові (тромбоз). Серед іншого, тромбоцити крові активуються під впливом дефіциту NO і таким чином спричиняють утворення згустків неприродним чином. Вони можуть виникати в різних частинах тіла, наприклад, у печінці або мозку, як у судинах, що постачають кров (артеріях), так і в судинах, що повертають кров (венах).
Симптоми та скарги ПНГ можуть бути постійними. Крім того, активація системи комплементу внаслідок інфекцій, вагітності або стресу може призвести до подальшого посилення симптомів, включаючи різке збільшення розпаду еритроцитів (гемолітичний криз). Цей стан може бути небезпечним для життя, якщо його не лікувати. Згустки крові можуть блокувати дрібні ниркові судини, що може призвести до гострої ниркової недостатності, а ризик тромбозу підвищується під час таких гемолітичних кризів. Під час цих фаз часто потрібні запаси крові (концентрати еритроцитів, КЕ).
3 Діагностика
Методом вибору для діагностики ПНГ є проточна цитофлуориметрія. Цей метод є дуже чутливим і тому може виявити дуже малу кількість патологічно змінених клітин. Крім того, можна дуже точно визначити частку уражених клітин (розмір клону ПНГ) і типи уражених клітин (наприклад, еритроцити або гранулоцити). Для цього тесту використовується кров з вени (периферична кров).
Подальші дослідження повинні бути проведені після встановлення первинного діагнозу:
- Історія хвороби (анамнез), в тому числі сім’ї, включаючи специфічне опитування щодо симптомів, характерних для ПНГ, див. 2 Симптоми
- Фізикальне обстеження з урахуванням особливостей, зазначених вище: Ознаки анемії, жовтяниця (icterus), ознаки гострого або попереднього тромбозу, ознаки кровотечі, конституціональні аномалії, як при вродженій апластичній анемії, збільшення селезінки (спленомегалія)
- Клітинні аналізи
-
- мікроскопічний диференційний аналіз крові
- Ретикулоцити
- Клінічна хімія
-
- Показники гемолізу: зокрема ЛДГ, гаптоглобін, білірубін
- Показники функції нирок: Креатинін, насичення трансферину
- Рівень вітаміну В12 та фолієвої кислоти
- Статус заліза: феритин, трансферин, насичення трансферину, гемоглобін ретикулоцитів. Якщо показники феритину > 1000 мкг/л, слід дослідити можливе ураження органів внаслідок перевантаження залізом.
- Значення BNP у сироватці крові для оцінки функції правого шлуночка
- Функціональна діагностика
-
- УЗД черевної порожнини
- Функція легень
- ЕКГ
-
-
Діагностика кісткового мозку за допомогою цитології, цитогенетики та гістології повинна бути проведена під час встановлення первинного діагнозу. Це особливо важливо, якщо цитопенія настільки виражена, що підозрюється зв’язок ПНГ з іншим гематологічним захворюванням, наприклад, апластичною анемією або мієлодиспластичним синдромом (МДС).
Якщо виявлено клітини ПНГ (клон ПНГ) або діагностовано синдром недостатності кісткового мозку, перевірки слід проводити кожні 6 місяців, особливо в перші два роки після встановлення первинного діагнозу, а також при появі нових симптомів. Відносна частка ПНГ-клону (розмір ПНГ-клону) до загальної кількості клітин кісткового мозку може коливатися і має важливе значення для подальшого перебігу захворювання, а також для визначення та моніторингу терапії.
4 Клінічний курс
4.1 Загальна інформація
Симптоми та проблеми ПНГ можуть сильно відрізнятися і призводити до погіршення якості життя через згадані вище симптоми.
Описані вище механізми розвитку захворювання можуть призвести, серед іншого, до підвищення артеріального тиску, підвищеного тиску в легеневому кровообігу (легеневої гіпертензії) та дисфункції нирок. Ці зміни можуть призвести до незворотних ушкоджень і потребують постійного моніторингу.
4.2 Згустки крові (тромбози/тромбоемболії)
Найстрашнішим ускладненням ПНГ є утворення згустків крові (тромбоз/тромбоемболія), що може призвести до закупорки кровоносних судин. У дослідженнях ймовірність виникнення тромбозу протягом 10 років становила понад 30 % без специфічного лікування ПНГ. Крім того, близько 30-50% всіх пацієнтів з ПНГ розвивають тромбози під час перебігу хвороби без специфічних терапевтичних заходів. Тромбоемболічні ускладнення є причиною до 67% усіх смертей при ПНГ. Ймовірність виникнення тромбозу може також залежати від кількості клітин ПНГ, хоча пацієнти з невеликою кількістю клітин ПНГ також мають підвищений ризик тромбозу.
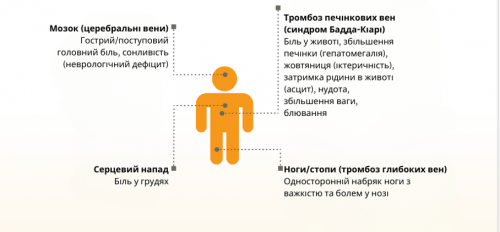
Тромбози у пацієнтів з ПНГ виникають у типових і менш типових місцях.
4.3 Порушення функції нирок
порушення фільтраційної функції, що призводить до порушення очищення плазми крові нирками. Кліренс креатиніну, який показує час, необхідний для очищення плазми крові від креатиніну, продукту розпаду м’язів, визначається як параметр функції нирок. Як функція фільтрації, так і кліренс креатиніну можуть погіршуватися в міру
4.4 Зменшення кількості клітин (цитопенія)
Значне зменшення кількості клітин крові через супутнє захворювання кісткового мозку є другою найпоширенішою причиною серйозних ускладнень – 20%. Приблизно у 15% пацієнтів розвивається апластична анемія з відсутністю всіх трьох клітинних ліній крові (панцитопенія). І навпаки, апластична анемія також може бути присутня спочатку, на основі якої потім розвивається ПНГ.
5 Терапія
5.1 Загальний огляд
Лікування ПНГ залежить від тяжкості скарг і симптомів. За відсутності відповідних симптомів виправданим є лише ретельне спостереження. Можуть бути розглянуті підтримуючі заходи та ліки для пригнічення згортання крові (антикоагуляція), зазвичай також відомі як розрідження крові. Антикоагуляція фактично не розріджує кров, але запобігає блокуванню (“потовщенню”) кровоносних судин згустками крові. При симптоматичній ПНГ форма лікування залежить, серед іншого, від тяжкості порушення кровотворення (гемолізу) та наявності згустків крові.
На наступній схемі показана концепція лікування гемолітичної ПНГ:
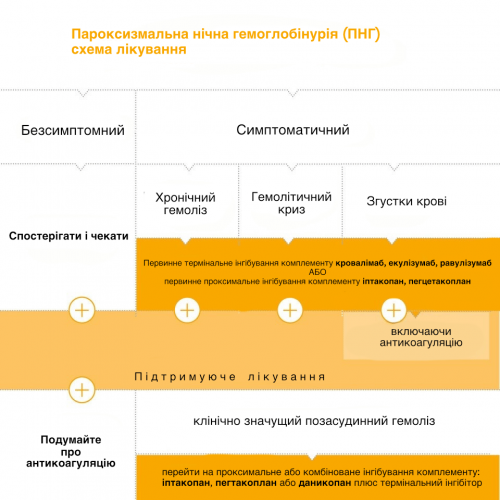
Спрощене представлення алгоритму терапії. Повний алгоритм проілюстровано в настановах DGHO на Onkopedia.
5.2 Специфічна терапія
Оскільки система комплементу атакує патологічно змінені еритроцити, руйнування можна придушити, інгібуючи її частину.
Таргетні препарати для лікування ПНГ, які були схвалені протягом певного часу, – це антитіло екулізумаб (Soliris®), яке було представлене у 2007 році, та його пролонгована форма равулізумаб (Ultomiris®), схвалена у 2019 році. Ці дві діючі речовини блокують активність білка С5 системи комплементу. Різні дослідження показали, що екулізумаб і равулізумаб значно зменшують руйнування еритроцитів у кровоносних судинах (внутрішньосудинний гемоліз) внаслідок блокади.
Це призвело до значного покращення якості життя пацієнтів з ПНГ, які отримували лікування екулізумабом/равулізумабом. Це спостерігалося навіть у пацієнтів, у яких рівень гемоглобіну не повернувся до норми. Це свідчить про те, що, окрім покращення стану анемії, частина ефекту зумовлена блокуванням самого порушення кровотворення (гемолізу).
Як подальший наслідок зменшення розчинення еритроцитів, спостерігалося значне зменшення потреби в переливанні крові, анемії, втоми, гострого болю в животі та зниження високого кров’яного тиску (артеріальної гіпертензії) і легеневої гіпертензії. Крім того, в дослідженнях описано покращення або навіть нормалізацію функції нирок після можливої попередньої ниркової дисфункції.
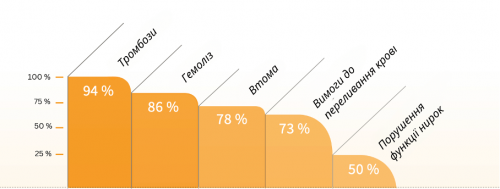
Ефект екулізумабу в лікуванні ПНГ
Медичні показання для лікування екулізумабом/равулізумабом включають
- Згустки крові
- Кризоподібний біль у животі
- Гемолітичні кризи
- Порушення функції нирок, пов’язане з ПНГ
- Потреба в переливанні крові
- Легенева гіпертензія, асоційована з ПНГ
Мета терапії – уникнути серйозних, небезпечних для життя ускладнень і подальшого пошкодження уражених органів. Екулізумаб/равулізумаб вводиться у вигляді інфузії у вену (внутрішньовенно) і може призначатися амбулаторно. Інфузію екулізумабу зазвичай проводять один раз на тиждень протягом перших 4 тижнів для насичення, а потім кожні 2 тижні в якості підтримуючої терапії. Равулізумаб, з іншого боку, необхідно вводити двічі на 2 тижні для насичення, а потім лише кожні 8 тижнів в якості підтримуючої терапії. На відміну від екулізумабу, дозування равулізумабу залежить від маси тіла. Тривалість інфузії також залежить від дозування.
Дані реєстраційних досліджень та поточних оцінок довготривалої терапії показують, що ці препарати загалом дуже добре переносяться. Дуже частим побічним ефектом може бути головний біль, який виникає лише на початку лікування. Інфекції, зміни в аналізах крові, безсоння, скарги з боку шлунково-кишкового тракту, проблеми зі шкірою, грипоподібні симптоми, втома та інші згадуються як часті побічні ефекти.
Через пригнічення системи комплементу організм не може адекватно захищатися від певних бактерій (менінгококів), які можуть спричинити зараження крові або бактеріальний менінгіт. Тому під час лікування екулізумабом/равулізумабом необхідно зробити щеплення від менінгококів. Рекомендується використовувати дві різні вакцини (Менвео®/Німенрикс® та Бексеро®/Труменба®), щоб охопити якомога більше штамів менінгококу (A, C, W135, Y на початку терапії та B під час поточної терапії), хоча 100% захист не досягається. Щеплення слід оновлювати кожні три роки.
У випадку лихоманки (температура > 38,0 °C), шкірного висипу, тяжкого відчуття нездужання або ригідності шиї дуже важливо якомога швидше застосувати “терапію очікування” (наприклад, ципрофлоксацин 750 мг) і негайно звернутися до лікаря, щоб розпочати подальшу діагностику та, за необхідності, розширену антибіотикотерапію. З квітня 2019 року ципрофлоксацин слід застосовувати лише при серйозних інфекціях. З огляду на небезпечну для життя менінгококову інфекцію, у цьому випадку виправданим є одноразове застосування цього препарату. Як альтернативу можна розглянути “резервну терапію” амоксициліном/клавулановою кислотою 1000 мг.
У дослідженнях було помічено, що пацієнти з ПНГ частіше скаржилися на головний біль після перших доз екулізумабу/равулізумабу. Це є ознакою хорошої ефективності препарату. Зменшення розпаду еритроцитів означає, що знову стає доступним більше оксиду азоту (NO) і кровоносні судини можуть розширюватися, але організм спочатку повинен знову звикнути до цього нормального стану.
Однак лікування екулізумабом не зменшує кількість хворих клітин і не виліковує хворобу. Навпаки, захист антитілами призводить до того, що менше патологічно змінених еритроцитів розпадається, і тому вони залишаються в більшій кількості. Збільшення кількості цих еритроцитів ПНГ є ознакою ефективної терапії. Дотримання регулярного інтервалу терапії (кожні 14 +/- 2 дні для екулізумабу або кожні 8 +/- 1 тиждень для равулізумабу) має важливе значення для забезпечення безперервного захисту уражених клітин та уникнення вищезгаданих ускладнень ПНГ (проривного гемолізу).
Через сповільнений розпад хворих еритроцитів із сечею виводиться менше або зовсім не виводиться гемоглобіну, а отже, і заліза. Завдяки усуненню цієї хронічної втрати заліза через нирки у деяких пацієнтів з ПНГ, які проходять терапію екулізумабом/равулізумабом, спостерігається збільшення запасів заліза в організмі. Тому їх слід регулярно перевіряти, особливо у випадку супутньої апластичної анемії, щоб на ранній стадії припинити лікування препаратами заліза і, за необхідності, вивести надлишок заліза за допомогою так званої хелатотерапії.
Незважаючи на успішне пригнічення екулізумабом/равулізумабом руйнування клітин всередині кровоносних судин (внутрішньосудинний гемоліз), зараз відбувається повільне розщеплення патологічно змінених еритроцитів поза судинами (позасудинний гемоліз), що запускається навантаженням попередників системи комплементу. Це можна виявити за допомогою спеціальних аналізів крові (наприклад, тесту Кумбса). Нові терапевтичні стратегії намагаються запобігти цьому шляхом блокування системи комплементу на ранній стадії, наприклад, Пегцетакоплан (Aspaveli®), який також був схвалений, та Іптакопан, який зараз проходить клінічні випробування.
5.3 Симптоматична терапія
Окрім специфічної терапії ПНГ екулізумабом/равулізумабом/пегцетакопланом, існують інші варіанти лікування симптомів, що виникають.
При появі симптомів анемії можна вводити еритроцитарні концентрати. Навіть якщо під час переливання надходить невелика кількість факторів комплементу, це не призводить до посилення комплемент-опосередкованого гемолізу. Це також стосується застосування тромбоцитарних концентратів, див. Апластична анемія, 5.5 Підтримуюча терапія > Переливання крові.
Якщо ПНГ не пов’язана безпосередньо з недостатністю кісткового мозку, вона називається “класичною ПНГ”. Якщо її не лікувати, вона часто призводить до дефіциту заліза через постійну втрату гемоглобіну через нирки. Оскільки залізо необхідне для утворення червоних кров’яних тілець, воно повинно надходити в організм у таких ситуаціях. Залізо можна приймати у вигляді таблеток або у вигляді інфузії через вену. Пероральні препарати слід приймати щодня або через день натщесерце. Крім того, залізо не слід приймати одночасно з антибіотиками або препаратами для нейтралізації шлункової кислоти (антацидами). Якщо розпочато відповідне лікування препаратами заліза, терапевтичне рішення на користь прийому препаратів заліза необхідно регулярно переглядати. Рівень феритину можна перевіряти в рамках медичних оглядів.
Через компенсаторне посилене утворення нових еритроцитів зростає потреба у фолієвій кислоті та, можливо, у вітаміні В12. У цьому випадку, як правило, слід давати додатково, наприклад, 5 мг фолієвої кислоти на день. У разі дефіциту вітаміну В12 слід призначати залежно від попередньо виміряного рівня.
Попередні дослідження показали, що ризик тромбозу пов’язаний з кількістю клітин ПНГ та рівнем гемолітичної активності. Якщо частка гранулоцитів з порушенням GPI становить понад 50 % та/або значення ЛДГ більш ніж у 1,5 рази перевищує верхню межу норми, то ймовірність виникнення тромбозу значно зростає. Якщо таким пацієнтам призначали профілактичний антикоагулянт, тромбози розвивалися значно рідше.
Тому застосовуються наступні рекомендації:
- Рішення про застосування антикоагулянтів слід приймати індивідуально для кожного пацієнта.
- Профілактична антикоагуляція не потрібна під час терапії екулізумабом/равулізумабом.
- Якщо профілактичну антикоагуляцію було розпочато до початку терапії екулізумабом/равулізумабом, можна розглянути можливість її відміни після нормалізації гемолітичної активності під час терапії екулізумабом/равулізумабом. Однак самостійне припинення лікування категорично не рекомендується.
- Якщо тромбоз вже стався, слід провести антикоагуляцію. Тривалість залежить від локалізації тромбозу та його перебігу.
- У ситуаціях ризику, таких як прикутість до ліжка, тривале обмеження рухів (гіпсова пов’язка), операції або тривалі (> приблизно 4-6 годин) поїздки автобусом чи літаком, слід призначити антикоагулянт (наприклад, у вигляді ін’єкції або таблетки) як профілактичний захід залежно від поточного рівня тромбоцитів.
- Бактеріальні інфекції слід розпізнавати на ранніх стадіях і послідовно лікувати антибіотиками, оскільки інфекції можуть призвести до гострого погіршення перебігу ПНГ з гемолітичним кризом.
- У випадку гемолітичної кризи слід забезпечити достатнє вживання рідини (гідратацію). Може знадобитися антибіотикотерапія, переливання крові та введення екулізумабу/равулізумабу, а також промивання крові (діаліз), якщо існує ризик для нирок.
- У виняткових випадках у разі супутньої дисфункції кісткового мозку (недостатності кісткового мозку) або після розвитку ниркової анемії може бути корисним введення гемопоетичних факторів росту, наприклад, еритропоетину або Г-КСФ.
- Якщо недостатність кісткового мозку (аплазія) є більш важливою, ніж ПНГ, слід провести імуносупресивну терапію або трансплантацію стовбурових клітин чи кісткового мозку, якщо необхідно, див. Апластична анемія, 5 Терапія.
Крім того, поточний статус вакцинації слід обговорити з гематологом, який лікує пацієнта, особливо щодо щеплень проти пневмонії, спричиненої пневмококами, та грипу, спричиненого вірусами грипу.
5.4 Зцілення
Єдиним методом лікування ПНГ з перспективою вилікування (лікувальним підходом) є алогенна трансплантація кісткового мозку або стовбурових клітин. Однак це пов’язано зі значними ускладненнями (захворюваністю) та смертністю. Тому терапевтичне рішення (показання) до трансплантації повинно прийматися дуже суворо, особливо з огляду на доступність терапії екулізумабом/равулізумабом/пегцетакопланом.
Медичними показаннями для трансплантації стовбурових клітин є
- Рецидивуючі, небезпечні для життя тромбоемболічні ускладнення, які не піддаються іншій терапії
- дуже важка гемолітична анемія, яка не піддається лікуванню (рефрактерна) і потребує переливання крові
- Наявність клону ПНГ з апластичною анемією (АА) або мієлодиспластичним синдромом (МДС), якщо АА або МДС вже є причиною для трансплантації
- Перехід до апластичної анемії, якщо імуносупресивна терапія не показана, або мієлодиспластичного синдрому
5.5 Перспективи
Багато нових речовин, які інгібують систему комплементу, наразі проходять клінічні випробування, див. розділ “Клінічні випробування”. Нещодавно, у грудні 2021 року, інгібітор С3 комплементу пегцетакоплан був схвалений для підшкірних інфузій пацієнтам з ПНГ, які все ще мають відповідну анемію після щонайменше 3 місяців терапії екулізумабом або равулізумабом. Інші препарати, зокрема таблетована/капсульна терапія (наприклад, іптакопан), демонструють багатообіцяючі результати.
6 Прогноз
Завдяки значному зниженню тромбоемболічних подій під час лікування екулізумабом/равулізумабом пацієнти з ПНГ мають майже таку ж тривалість життя, як і здорова популяція.
7 Бажання мати дітей/вагітність
Ще кілька років тому пацієнткам з ПНГ не рекомендували вагітніти, оскільки часто спостерігалися ускладнення, що загрожували життю як матері, так і дитини. Оскільки цей ризик значно знижується при лікуванні антитілами, питання планування сім’ї знову стало актуальним. Тим часом, звіти про вагітності на тлі терапії екулізумабом доступні і демонструють дуже обнадійливі результати, хоча кількість випадків обмежена. Вагітності протікали в основному без ускладнень, і всі діти були здорові. Проте, якщо пацієнтка бажає мати дітей або завагітніла, її слід скерувати до спеціалізованого центру з гематологічним та гінекологічним відділеннями для з’ясування індивідуального профілю ризику пацієнтки та, за необхідності, коригування дози екулізумабу.
8 Реєстри
Оскільки ПНГ є надзвичайно рідкісним захворюванням, релевантну інформацію про хворобу та терапію можна отримати, лише проаналізувавши дані якомога більшої кількості пацієнтів з ПНГ на міжнародному рівні.
З цією метою було створено Міжнародний реєстр пацієнтів з ПНГ. За згодою пацієнта, кожні 6 місяців він документує дані про перебіг хвороби та якість життя в анонімній формі. Оскільки ця інформація – єдиний спосіб отримати нові знання про хворобу та вдосконалити лікування, якомога більше пацієнтів з ПНГ повинні погодитися надати свої дані до реєстру.
ПРИЄДНУЙТЕСЯ!
Якщо ви зацікавлені або маєте запитання, будь ласка, надішліть електронного листа професору Олександру Рету (alexander.roeth(at)ukessen.de) або професору Губерту Шрезенмайєру (h.schrezenmeier(at)blutspende.de).

