Paroxysmale Nächtliche Hämoglobinurie (PNH)
1 Was ist eine PNH
2 Symptome
3 Diagnostik
4 Klinischer Verlauf
5 Therapie
6 Prognose
7 Kinderwunsch/Schwangerschaft
8 Register
1 Was ist eine PNH
1.1 Allgemeines
Die Paroxysmale Nächtliche Hämoglobinurie (PNH) ist ebenso wie die Aplastische Anämie keine bösartige, aber eine sehr seltene und potenziell lebensbedrohliche Erkrankung. Ihr liegt ein erworbener Defekt der blutbildenden Stammzellen des Knochenmarks zugrunde, der nicht vererbbar ist.
1.2 Vorkommen (Epidemiologie)
Die Krankheitshäufigkeit (Inzidenz) liegt bei 1-2 Neuerkrankungen pro 1 Million Menschen und Jahr. Infolge der Vielfältigkeit der Beschwerden muss man jedoch davon ausgehen, dass die PNH zu selten diagnostiziert wird, da sie oft nicht erkannt wird. Am häufigsten wird die Erkrankung zwischen dem 25. und 45. Lebensjahr diagnostiziert, wobei beide Geschlechter etwa gleich häufig betroffen sind. Eine familiäre Häufung liegt nicht vor.
1.3 Entstehung (Pathogenese)
Die PNH kommt durch eine genetische Veränderung (Mutation) blutbildender Stammzellen im Knochenmark zustande. Diese Veränderung ist nicht von Geburt an vorhanden, sondern entsteht erst im Laufe des Lebens (somatische Genmutation) und kann nicht an die Nachkommen vererbt werden. Es können gesunde und kranke Zellen gleichzeitig nebeneinander vorliegen (Mosaik).
Diese Genmutation liegt typischerweise in einem speziellen Abschnitt des Erbguts, dem PIG-A-Gen, und betrifft eine oder mehrere blutbildende Stammzellen des Knochenmarks. Das Gen erzeugt einen Biokatalysator (Enzym), der normalerweise für die Produktion eines speziellen Ankersystems, dem Glykosylphosphatidylinositol-Anker (GPI-Anker), benötigt wird. Dieser befindet sich an der Zellmembran und dient der Befestigung zahlreicher Eiweiße (Proteine) auf der Zellmembran, die u.a. der Regulation des Immunsystems dienen. Auf diese Weise schützen sie die Zellen z.B. vor einem Angriff durch einen bestimmten Teil des Immunsystems, dem sogenannten Komplementsystem, indem sie die Zellen als nicht-fremd markieren.
Zwei dieser Proteine spielen dabei eine besonders wichtige Rolle:
- Complement Decay Accelerating Factor (DAF, CD55)
- Protectin (MAC-IP: Membrane Attack Complex Inhibitory Protein, MIRL: Membrane Inhibitor of Reactive Lysis, CD59)
Eine Verminderung oder das komplette Fehlen der GPI-verankerten Proteine auf der Zellmembran der Erythrozyten, Leukozyten und Thrombozyten macht diese Zellen anfälliger für die Zerstörung durch das Komplementsystem. Dabei kommt es zu einem Platzen der Erythrozyten in den Blutgefäßen (intravasale Hämolyse) und zu einer Aktivierung der Blutplättchen, was zu Thrombosen führen kann.
Das Komplementsystem dient dem Körper zur Abwehr von Infektionserregern, Parasiten, fremden Molekülen etc. Wenn es aktiviert wird, beginnt ein fortschreitender kaskadenartiger Prozess (Komplementkaskade), der mit der Zerstörung der Zielzelle enden kann.
2 Symptome
2.1 Verminderte Zellzahlen (Zytopenien)
Blutarmut (Anämie)
Der Zerfall der roten Blutkörperchen (Hämolyse) kann zu einer Blutarmut (Anämie) führen und damit dem Fehlen von Sauerstofftransportern (Hämoglobin).
Zu den Symptomen zählen:
- Blässe der Haut (unspezifisches Zeichen)
- Leistungsabfall, Konzentrationsschwäche, Depression, Müdigkeit, schwere Beine, rasche Ermüdung
- Kurzatmigkeit (Dyspnoe) unter Belastung infolge einer verminderten Zahl von Sauerstofftransportern
- Schwindel, Ohrensausen, gesteigerte Herzfrequenz (Tachykardie), Brustenge (Angina pectoris), Sehstörungen
Die Anämie kann so stark sein, dass die Transfusion roter Blutkörperchen (Erythrozytenkonzentrate) notwendig wird.
Weitere verringerte Zellreihen
Neben der roten Zellreihe können auch andere Blutzellreihen vermindert (Zytopenie) sein wie z.B. die Blutplättchen (Thrombozytopenie) oder die Granulozyten (Neutropenie). Dies ist meist Ausdruck der begleitenden Aplastischen Anämie.
2.2 Auswirkungen der Hämolyse
Durch den Zerfall der roten Blutkörperchen fällt vermehrt der Gallenfarbstoff Bilirubin im Blut an. Dadurch kann es zu einer Gelbfärbung der Haut und der weißen äußeren Haut des Augapfels (Sklera) kommen. Man spricht dann auch von einer Gelbsucht (Ikterus bzw. Sklerenikterus).
Zusätzlich wird beim Zerfall der roten Blutkörperchen Hämoglobin freigesetzt. Bei einem sehr hohen Anfall an freiem Hämoglobin kann dies über die Niere ausgeschieden werden und führt zu einem dunklen, rotbraunen oder sogar schwarzen Urin (Hämoglobinurie).
Über verschiedene Zwischenschritte führt das freie Hämoglobin zu einer verringerten Verfügbarkeit von Stickstoffmonoxid (NO). Stickstoffmonoxid wird für die Erschlaffung der glatten Muskulatur benötigt, die sich z. B. im Magen-Darm-Trakt oder in der Lunge befindet. Ist es nicht ausreichend verfügbar, führt dies zur Anspannung der glatten Muskulatur u.a. mit Krämpfen, einer Engstellung von Gefäßen und einem dadurch erhöhten Blutdruck.
Durch diesen Wirkmechanismus werden zahlreiche der klinischen Symptome der PNH erklärt:
- Starke, oft krisenhafte Bauchschmerzen
- Verkrampfung der Speiseröhre mit Schluckstörungen (Dysphagie)
- Bluthochdruck
- Hochdruck im Lungenkreislauf (pulmonale Hypertonie) mit Luftnot
- Einschränkung der Nierenfunktion
- Erektionsstörungen (erektile Dysfunktion)
2.3 Erschöpfung (Fatigue)
Unter Fatigue versteht man eine unnatürlich andauernde Müdigkeit oder Erschöpfung, die die körperliche und geistige Leistungsfähigkeit deutlich beeinträchtigen kann. Sie ist dadurch gekennzeichnet, dass auch durch vermehrte Ruhe oder Schlaf keine oder nur eine unzureichende Besserung eintritt.
Mögliche Ursachen für die Fatigue sind neben einer Anämie und der Zerstörung der roten Blutkörperchen mit dem dadurch resultierenden Mangel an Stickstoffmonoxid (NO) Störungen des Immunsystems oder des Stoffwechsels.
2.4 Thromboseneigung (Thrombophilie)
Eine der gefährlichsten Folgen des Mangels an Stickstoffmonoxid ist die Ausbildung von Blutgerinnseln (Thrombosen). U.a. werden die Blutplättchen durch den NO-Mangel aktiviert und verursachen so auf unnatürliche Weise Gerinnsel. Sie können in den verschiedensten Stellen des Körpers, z.B. in der Leber oder dem Gehirn, sowohl in blutversorgenden (Arterien) als auch in den blutzurückführenden Gefäßen (Venen) auftreten.
Die Symptome und Beschwerden der PNH können dauernd vorliegen. Zusätzlich kann es bei einer Aktivierung des Komplementsystems durch Infekte, Schwangerschaft oder Stress zu einer weiteren Verstärkung der Symptome bis hin zum stark gesteigerten Zerfall der roten Blutkörperchen (hämolytische Krise) kommen. Dieser Zustand kann unbehandelt lebensbedrohlich sein. Blutgerinnsel können die kleinen Nierengefäße verstopfen, was zum akuten Nierenversagen führen kann, und das Risiko für Thrombosen während dieser hämolytischer Krisen ist erhöht. In diesen Phasen werden häufig Blutkonserven (Erythrozytenkonzentrate, EKs) benötigt.
3 Diagnostik
Die Untersuchungsmethode der Wahl für die Diagnostik der PNH ist die sogenannte Durchflusszytometrie. Diese Methode ist sehr empfindlich und kann daher auch eine sehr kleine Anzahl an krankhaft veränderten Zellen nachweisen. Außerdem können der Anteil der betroffenen Zellen (PNH-Klongröße) und die betroffenen Zellarten (z.B. Erythrozyten oder Granulozyten) sehr genau bestimmt werden. Für diese Untersuchung wird Blut aus der Vene (peripheres Blut) verwendet.
Bei Erstdiagnose sollten weitere Untersuchungen durchgeführt werden:
-
- mikroskopisches Differenzialblutbild
- Retikulozyten
-
- Hämolyse-Parameter: insbesondere LDH, Haptoglobin, Bilirubin
- Nierenfunktionsparameter: Kreatinin, Transferrinsättigung
- Vitamin B12- und Folsäurespiegel
- Eisenstatus: Ferritin, Transferrin, Transferrinsättigung, Retikulozyten-Hämoglobin. Bei Ferritin-Werten > 1000 µg/l sollte eine Abklärung von möglichen Organschäden durch eine Eisenüberladung durchgeführt werden.
- BNP-Wert im Blutserum zur Einschätzung der Funktion der rechten Herzkammer
Eine Knochenmarkdiagnostik mit Zytologie, Zytogenetik und Histologie sollte zum Zeitpunkt der Erstdiagnose durchgeführt werden. Das ist besonders wichtig, wenn gleichzeitig eine Zytopenie eines so hohen Ausmaßes besteht, dass der Verdacht auf eine PNH in Zusammenhang mit einer anderen hämatologischen Erkrankung, z.B. Aplastischer Anämie oder Myelodysplastischem Syndrom (MDS), besteht.
Bei Nachweis von PNH-Zellen (PNH-Klon) oder der Diagnose eines Knochenmarkversagenssyndroms sollten Kontrollen insbesondere in den ersten beiden Jahren nach Erstdiagnose alle 6 Monate sowie bei neu aufgetretenen Beschwerden durchgeführt werden. Der relative Anteil des PNH-Klons (PNH-Klongröße) an der Gesamtzahl der Knochenmarkzellen kann schwanken und ist für den weiteren Verlauf der Erkrankung sowie die Festlegung und Kontrolle der Therapie wichtig.
4 Klinischer Verlauf
4.1 Allgemeines
Die Beschwerden und Probleme der PNH können sehr unterschiedlich sein und zu einer Beeinträchtigung der Lebensqualität durch die oben genannten Symptome führen.
Durch die beschriebenen Mechanismen der Erkrankung kann es u.a. zu einem Bluthochdruck, einem Hochdruck im Lungenkreislauf (pulmonale Hypertonie) und Nierenfunktionsstörungen kommen. Diese Veränderungen können zu dauerhaften Schäden führen und bedürfen einer stetigen Verlaufskontrolle.
4.2 Blutgerinnsel (Thrombosen/Thromboembolien)
Die gefürchtetste Komplikation der PNH ist die Entstehung von Blutgerinnseln (Thrombosen/Thromboembolien), die zu Verstopfungen von Blutgefäßen führen können. Die Wahrscheinlichkeit für das Auftreten einer Thrombose betrug in Studien ohne eine spezielle Therapie der PNH über 30 % innerhalb von 10 Jahren. Zudem entwickeln ungefähr 30-50 % aller PNH-Patienten ohne spezifische Therapiemaßnahmen im Verlauf ihrer Erkrankung Thrombosen. Thromboembolische Komplikationen sind bei der PNH ursächlich für bis zu 67 % aller Todesfälle. Die Wahrscheinlichkeit, eine Thrombose zu erleiden, hängt möglicherweise auch von der Menge der PNH-Zellen ab, wobei auch für Patienten mit Nachweis von nur wenigen PNH-Zellen ein erhöhtes Thromboserisiko besteht.
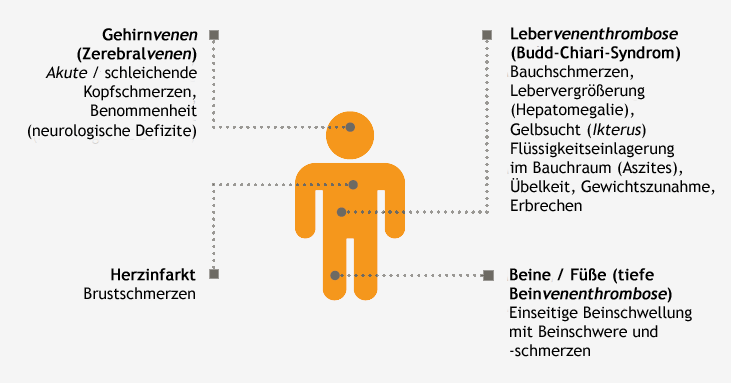
Thrombosen bei PNH-Patienten treten an typischen und weniger typischen Stellen auf.
4.3 Nierenfunktionsstörung
Bei zwei Drittel aller Patienten mit PNH findet sich eine Beeinträchtigung der Nierenfunktion. Es überwiegen eine gestörte Filterfunktion und dadurch eine verschlechterte Reinigung des Blutplasmas durch die Nieren. Als Parameter für die Nierenfunktion wird die Kreatinin-Clearance bestimmt, die die Dauer angibt, in der das Blutplasma vom Kreatinin, einem Muskelabbauprodukt, gereinigt wird. Sowohl die Filterfunktion als auch die Kreatinin-Clearance können sich im Verlauf der Krankheit verschlechtern.
4.4 Verminderung von Zellzahlen (Zytopenien)
Die deutliche Verminderung der Blutzellen aufgrund einer begleitenden Knochenmarkerkrankung ist mit 20 % die zweithäufigste Ursache für schwerwiegende Komplikationen. Etwa 15 % der Patienten entwickeln im Verlauf eine Aplastische Anämie mit dem Fehlen aller drei Blutzellreihen (Panzytopenie). Umgekehrt kann auch zuerst eine Aplastische Anämie vorliegen, auf deren Boden sich dann eine PNH entwickelt.
5 Therapie
5.1 Übersicht
Die Behandlung der PNH hängt von der Ausprägung der Beschwerden und den Symptomen ab. Liegen keine relevanten Beschwerden vor, ist es gerechtfertigt, nur engmaschige Kontrollen durchzuführen. Unterstützende (supportive) Maßnahmen und eine medikamentöse Hemmung der Blutgerinnung (Antikoagulation), üblicherweise auch Blutverdünnung genannt, können erwogen werden. Durch die Antikoagulation wird das Blut nicht bildlich verdünnt, sondern sie verhindert die Verstopfung („Verdickung“) der Gefäße durch Blutgerinnsel. Bei der symptomatischen PNH hängt die Behandlungsform u.a. von der Schwere der Blutzerstörung (Hämolyse) und dem Vorliegen von Blutgerinnseln ab.
In der folgenden Grafik wird das Behandlungskonzept der hämolytischen PNH dargestellt:
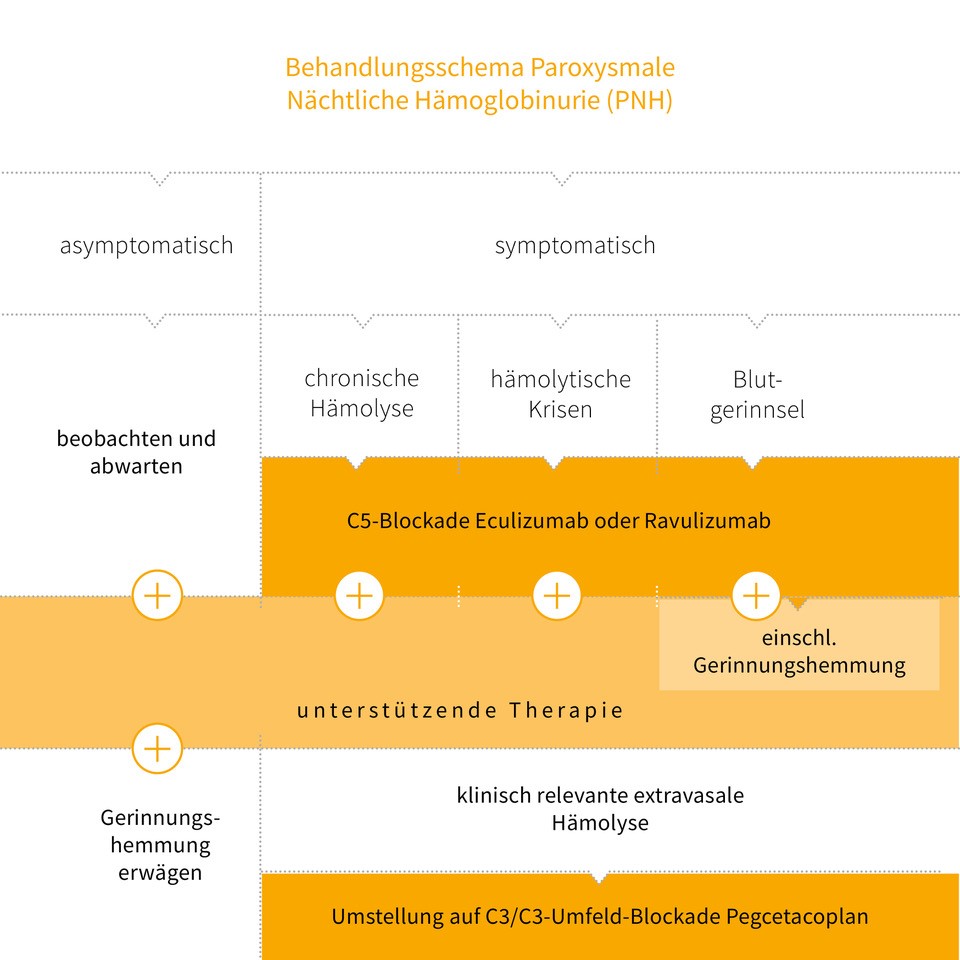
Vereinfachte Darstellung des Therapiealgorithmus. Der vollständige Algorithmus ist abgebildet in den Leitlinien der DGHO auf Onkopedia.
5.2 Spezifische Therapie
Da das Komplementsystem die krankhaft veränderten roten Blutkörperchen angreift, kann man durch die Hemmung eines Teils davon die Zerstörung unterdrücken.
Die seit längerem zugelassenen zielgerichteten Therapien der PNH sind der 2007 eingeführte Antikörper Eculizumab (Soliris®) und dessen langwirksame Form Ravulizumab (Ultomiris®), die 2019 zugelassen wurde. Diese beiden Wirkstoffe blockieren die Aktivität des Proteins C5 des Komplementsystems. Verschiedene Studien konnten zeigen, dass Eculizumab bzw. Ravulizumab durch die Blockade die Zerstörung der roten Blutkörperchen in den Blutgefäßen (intravasale Hämolyse) stark reduziert.
Es zeigte sich dadurch eine erhebliche Verbesserung der Lebensqualität bei den mit Eculizumab/Ravulizumab behandelten PNH-Patienten. Dies war sogar bei den Patienten zu beobachten, bei denen keine Normalisierung der Hämoglobinwerte eintrat. Das spricht dafür, dass neben der Besserung der Anämie ein Teil der Wirkung auf die Blockade der Blutzerstörung (Hämolyse) selbst zurückzuführen ist.
Als weitere Folge der verringerten Auflösung der roten Blutkörperchen kam es zu einer deutlichen Abnahme des Transfusionsbedarfs, der Anämie, der Erschöpfung (Fatigue), der krisenhaften Bauchschmerzen sowie zu einer Verringerung des Bluthochdrucks (arterieller Hypertonus) und Lungenhochdrucks (pulmonale Hypertonie). Außerdem war in den Studien eine Verbesserung oder sogar Normalisierung der Nierenfunktion nach einer evtl. vorherigen Nierenfunktionsstörung beschrieben worden.
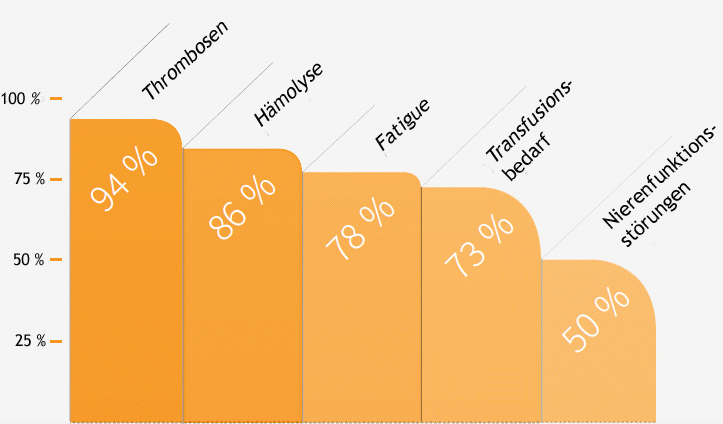
Wirkung von Eculizumab in der Behandlung der PNH
Medizinische Gründe für eine Therapie mit Eculizumab/Ravulizumab sind u. a.
- Blutgerinnsel
- Krisenhafte Bauchschmerzen
- Hämolytische Krisen
- PNH-bedingte Störung der Nierenfunktion
- Transfusionsbedürftigkeit
- mit PNH einhergehender Lungenhochdruck (pulmonale Hypertonie)
Ziel einer Therapie ist die Vermeidung schwerwiegender, lebensbedrohlicher Komplikationen und Folgeschäden der betroffenen Organe. Die Gabe von Eculizumab/Ravulizumab erfolgt als Infusion in eine Vene (intravenös) und kann ambulant durchgeführt werden. Üblicherweise wird die Infusion von Eculizumab in den ersten 4 Wochen einmal wöchentlich zur Aufsättigung und im Anschluss alle 2 Wochen als Erhaltungstherapie gegeben. Dagegen muss Ravulizumab zur Aufsättigung zweimal im Abstand von 2 Wochen gegeben werden und danach nur noch alle 8 Wochen in Erhaltungstherapie. Im Gegensatz zu Eculizumab erfolgt die Dosierung von Ravulizumab in Abhängigkeit vom Körpergewicht. Die Laufzeit der Infusion richtet sich wiederum nach der Dosierung.
Die Daten der Zulassungsstudien und aktuelle Auswertungen zur Langzeittherapie zeigen, dass es sich insgesamt um sehr gut verträgliche Therapien handelt. Als sehr häufige Nebenwirkung können Kopfschmerzen auftreten, was nur zu Beginn der Therapie vorkommt. Infektionen, Blutbildveränderungen, Schlaflosigkeit, Magen-Darm-Beschwerden, Hautprobleme, grippeähnliche Symptome, Fatigue und weitere werden als häufige Nebenwirkungen genannt.
Aufgrund der Hemmung des Komplementsystems kann sich der Körper nur unzureichend gegen bestimmte Bakterien (Meningokokken) schützen, die eine Blutvergiftung oder eine bakterielle Hirnhautentzündung verursachen können. Daher ist unter einer Therapie mit Eculizumab/Ravulizumab zwingend eine Schutzimpfung gegen Meningokokken notwendig. Es wird empfohlen, mit zwei verschiedenen Impfstoffen (Menveo®/Nimenrix® und Bexsero®/Trumenba®) möglichst viele der Meningokokkenstämme (A, C, W135, Y zu Therapiebeginn und B unter laufender Therapie) abzudecken, wobei trotzdem kein 100%iger Schutz erreicht wird. Die Schutzimpfungen sollten alle drei Jahre aufgefrischt werden.
Bei Fieber (Temperatur > 38,0 °C), Hautausschlag, starkem Krankheitsgefühl oder Nackensteife ist es entscheidend, dass schnellstmöglich eine „Stand-by-Therapie“ (z.B. Ciprofloxacin 750 mg) erfolgt und sofort ein Arzt aufgesucht wird, um die weitere Diagnostik und ggf. eine erweiterte Antibiotikatherapie einzuleiten. Seit April 2019 soll Ciprofloxacin nur noch bei schweren Infektionen eingesetzt werden. Angesichts einer lebensbedrohlichen Infektion mit Meningokokken ist der einmalige Einsatz dieses Medikaments in diesem Fall gerechtfertigt. Als Alternative käme eine „Stand-by-Therapie“ mit Amoxicillin/Clavulansäure 1000 mg in Frage.
In Studien war auffällig, dass PNH-Patienten nach den ersten Gaben der Eculizumab/Ravulizumab-Dosen verstärkt über Kopfschmerzen klagten. Dies ist ein Zeichen für die gute Wirksamkeit des Medikaments. Durch die Abnahme des Zellzerfalls der roten Blutkörperchen ist wieder mehr Stickstoffmonoxid (NO) verfügbar, die Blutgefäße können sich erweitern, aber der Körper muss sich erst wieder an diesen Normalzustand gewöhnen.
Durch die Therapie mit Eculizumab wird jedoch die Anzahl der kranken Zellen nicht vermindert oder die Erkrankung geheilt. Im Gegenteil, durch den Antikörper-Schutz zerfallen weniger der krankhaft veränderten roten Blutkörperchen, die somit vermehrt vorliegen. Ein Anstieg der Anzahl dieser PNH-Erythrozyten ist also ein Zeichen für eine wirksame Therapie. Das Einhalten des regelmäßigen Therapieintervalls (alle 14 +/- 2 Tage für Eculizumab bzw. alle 8 +/- 1 Wochen für Ravulizumab) ist unerlässlich, um den kontinuierlichen Schutz der kranken Zellen zu gewährleisten und die erwähnten Komplikationen der PNH (Durchbruchhämolyse) zu vermeiden.
Durch den verminderten Zerfall der kranken roten Blutkörperchen wird weniger oder kein Hämoglobin und damit kein Eisen mehr über den Urin ausgeschieden. Durch den Wegfall dieses chronischen Verlusts an Eisen über die Niere beobachtet man bei einigen PNH-Patienten unter einer Eculizumab/Ravulizumab-Therapie einen Anstieg der Eisenspeicher. Diese sollten daher regelmäßig, insbesondere bei begleitender relevanter Aplastischer Anämie, kontrolliert werden, um eine eventuell laufende Behandlung mit Eisentabletten frühzeitig abzusetzen und bei Bedarf das überschüssige Eisen durch eine sogenannte Chelattherapie zu entfernen.
Trotz der erfolgreichen Unterdrückung der Zellzerstörung innerhalb der Blutgefäße (intravasale Hämolyse) durch Eculizumab/Ravulizumab findet nun neu ein langsamer Abbau der krankhaft veränderten roten Blutkörperchen außerhalb der Gefäße (extravasale Hämolyse) statt, ausgelöst durch eine Beladung mit Vorstufen des Komplementsystems. Diese kann durch spezielle Blutuntersuchungen (u.a. Coombs-Test) nachgewiesen werden. Neue Therapiestrategien versuchen, dies durch eine frühe Blockade des Komplementsystems zu vermeiden, z.B. das ebenfalls zugelassene Pegcetacoplan (Aspaveli®) und das in klinischer Erprobung befindliche Iptacopan.
5.3 Symptomatische Therapie
Neben der spezifischen PNH-Therapie mit Eculizumab/Ravulizumab/Pegcetacoplan gibt es weitere Möglichkeiten zur Behandlung der auftretenden Beschwerden.
Bei Anämie-Symptomen können Erythrozytenkonzentrate verabreicht werden. Auch wenn durch die Transfusion geringe Mengen an Komplementfaktoren zugeführt werden, kommt es dabei nicht zu einer Verstärkung der Komplement-vermittelten Hämolyse. Dies gilt auch für den Einsatz von Thrombozytenkonzentraten, siehe Aplastische Anämie, 5.5 Unterstützende Therapie > Blutübertragungen.
Steht eine PNH nicht im direkten Zusammenhang mit einem Knochenmarkversagen, nennt man sie „klassische PNH“. Unbehandelt kommt es dabei häufig zu einem Eisenmangel durch den ständigen Verlust von Hämoglobin über die Nieren. Da Eisen für die Bildung roter Blutkörperchen notwendig ist, muss es in diesen Situationen zugeführt werden. Eisen kann in Form von Tabletten oder als Infusion über die Vene gegeben werden. Orale Präparate sollten täglich oder jeden zweiten Tag auf nüchternen Magen eingenommen werden. Des Weiteren sollte das Eisen nicht gleichzeitig mit Antibiotika oder Arzneimitteln zur Neutralisierung der Magensäure (Antazida) eingenommen werden. Wird eine entsprechende Eisenbehandlung begonnen, muss die Therapieentscheidung für die Eisenergänzung regelmäßig überprüft werden. Hierzu eignet sich die Kontrolle des Ferritinwerts im Rahmen der ärztlichen Kontrolluntersuchungen.
Durch die kompensatorisch verstärkte Neubildung der roten Blutkörperchen liegt ein vermehrter Bedarf an Folsäure und ggf. auch Vitamin B12 vor. Hier sollte generell eine Ergänzung mit z.B. 5 mg Folsäure pro Tag erfolgen. Vitamin B12 sollte in Abhängigkeit vom vorher gemessenen Spiegel bei einem Mangel gegeben werden.
In früheren Studien konnte beobachtet werden, dass das Risiko für Thrombosen mit der Menge der PNH-Zellen und der Stärke der hämolytischen Aktivität einhergeht. Beträgt der Anteil GPI-gestörter Granulozyten mehr als 50 % und/oder der LDH-Wert mehr als das 1,5fache des oberen Normwerts, nimmt das Auftreten von Thrombosen deutlich zu. Wurde solchen Patienten eine vorbeugende Gerinnungshemmung verabreicht, entwickelten sie erheblich seltener Thrombosen.
Daher gelten folgende Empfehlungen:
- Über den Einsatz eines gerinnungshemmenden Medikaments sollte bei jedem Patienten individuell entschieden werden.
- Unter einer Eculizumab/Ravulizumab-Therapie ist eine vorbeugende Gerinnungshemmung nicht notwendig.
- Sollte vor einer Eculizumab/Ravulizumab-Therapie eine vorbeugende Gerinnungshemmung begonnen worden sein, kann erwogen werden, diese nach der Normalisierung der hämolytischen Aktivität während der Eculizumab/Ravulizumab-Therapie zu beenden. Von einem eigenständigen Absetzen ist jedoch strengstens abzuraten.
- Wenn bereits eine Thrombose aufgetreten ist, sollte eine Gerinnungshemmung durchgeführt werden. Die Dauer hängt von der Lokalisation der Thrombose und dem Verlauf ab.
- Bei Risikosituationen wie z.B. Bettlägerigkeit, längerfristiger Bewegungseinschränkung (Gips), Operationen oder längeren (> ca. 4-6 Stunden) Bus- oder Flugreisen sollte in Abhängigkeit von den aktuellen Thrombozytenwerten vorbeugend eine Gerinnungshemmung (z.B. als Spritze oder Tablette) durchgeführt werden.
- Bakterielle Infektionen sollten frühzeitig erkannt und konsequent mit einem Antibiotikum behandelt werden, da es im Rahmen von Infekten zu einer akuten Verschlechterung der PNH mit einer hämolytischen Krise kommen kann.
- Bei einer hämolytischen Krise soll eine ausreichende Flüssigkeitszufuhr (Hydrierung) erfolgen. Ggf. sind eine antibiotische Therapie, Transfusionen und Eculizumab/Ravulizumab-Gaben sowie – bei Gefahr für die Nieren – eine Blutwäsche (Dialyse) erforderlich.
- In Ausnahmefällen kann bei begleitender Knochenmarkfunktionsstörung (Knochenmarkinsuffizienz) oder nach Entwicklung einer nierenbedingten (renalen) Anämie die Gabe blutbildender (hämatopoetischer) Wachstumsfaktoren, z.B. Erythropoetin oder G-CSF, sinnvoll sein.
- Steht das Knochenmarkversagen (Aplasie) gegenüber der PNH im Vordergrund, sollte ggf. eine immunsuppressive Therapie oder eine Stammzell- bzw. Knochenmarktransplantation erfolgen, siehe Aplastische Anämie, 5 Therapie.
Außerdem sollte mit dem behandelnden Hämatologen der aktuelle Impfstatus besprochen werden, insbesondere im Hinblick auf Impfungen gegen Lungenentzündung durch Pneumokokken und Grippe durch Influenza-Viren.
5.4 Heilung
Die einzige Therapie der PNH mit Aussicht auf eine Heilung (kurativer Ansatz) ist die allogene Knochenmark- bzw. Stammzelltransplantation. Allerdings geht sie mit einer erheblichen Komplikations- (Morbiditäts-) und Sterblichkeits- (Mortalitäts-)rate einher. Daher sollte die Therapieentscheidung (Indikation) für eine Transplantation sehr streng gestellt werden, insbesondere seit der Verfügbarkeit der Antikörpertherapie mit Eculizumab/Ravulizumab/Pegcetacoplan.
Medizinische Gründe für eine Stammzelltransplantation sind
- wiederkehrende, lebensbedrohliche thromboembolische Komplikationen, die auf eine anderweitige Therapie nicht ansprechen
- eine sehr schwere, nicht durch eine Therapie beeinflussbare (refraktäre) hämolytische Anämie, die Transfusionen erforderlich macht
- Vorliegen eines PNH-Klons bei einer Aplastischen Anämie (AA) oder einem Myelodysplastischen Syndrom (MDS), wenn AA oder MDS bereits einen Transplantationsgrund darstellen
- Übergang in eine Aplastische Anämie, wenn eine immunsuppressive Therapie nicht indiziert ist, oder ein Myelodysplastisches Syndrom
5.5 Ausblick
Derzeit werden viele neue Substanzen, die das Komplementsystem hemmen, in klinischen Studien geprüft, siehe Klinische Studien. Zuletzt wurde im Dezember 2021 der C3-Komplementinhibitor Pegcetacoplan als subkutane Infusion für PNH-Patienten zugelassen, die unter einer mindestens 3-monatigen Therapie mit Eculizumab oder Ravulizumab noch immer eine relevante Anämie haben. Weitere Medikamente, insbesondere Tabletten-/Kapseltherapien (z.B. Iptacopan), zeigen vielversprechende Ergebnisse.
6 Prognose
Durch die deutliche Reduktion der thromboembolischen Ereignisse unter der Therapie mit Eculizumab/Ravulizumab haben PNH-Patienten annähernd die gleiche Lebenserwartung wie die Normalbevölkerung.
7 Kinderwunsch/Schwangerschaft
Bis vor wenigen Jahren hat man PNH-Patientinnen von Schwangerschaften abgeraten, da häufig lebensbedrohliche Komplikationen bei Mutter und Kind beobachtet wurden. Da unter der Antikörpertherapie dieses Risiko deutlich verringert ist, wird das Thema Familienplanung wieder bedeutsam. Zwischenzeitlich liegen Berichte zu Schwangerschaften unter Eculizumab-Therapie vor und zeigen sehr ermutigende Ergebnisse, wobei die Fallzahlen begrenzt sind. Die Schwangerschaften verliefen im Wesentlichen komplikationslos und alle Kinder waren gesund. Dennoch sollte bei einem entsprechenden Kinderwunsch bzw. bei einer Schwangerschaft die Anbindung an ein spezialisiertes Zentrum mit hämatologischen und gynäkologischen Fachbereichen erfolgen, um das individuelle Risikoprofil der Patientin zu klären und ggf. auch die Dosis von Eculizumab anzupassen.
8 Register
Da es sich bei der PNH um eine extrem seltene Erkrankung handelt, können relevante Informationen zur Erkrankung und Therapie nur über die Auswertung der Daten möglichst vieler PNH-Patienten auf internationaler Ebene gewonnen werden.
Zu diesem Zweck wurde das Internationale PNH-Patientenregister aufgelegt. Es dokumentiert nach Patienteneinwilligung alle 6 Monate Daten zum Verlauf der Erkrankung und zur Lebensqualität in anonymisierter Form. Da nur über solche Informationen neue Erkenntnisse zu der Erkrankung gewonnen und eine weitere Verbesserung der Therapie erreicht werden können, sollten sich möglichst alle PNH-Patienten bereiterklären, ihre Daten dem Register zur Verfügung zu stellen.
MACHEN SIE MIT!
Bei Interesse oder Rückfragen wenden Sie sich bitte per E-Mail an Prof. Dr. med. Alexander Röth (alexander.roeth(at)ukessen.de) oder an Prof. Dr. med. Hubert Schrezenmeier (h.schrezenmeier(at)blutspende.de).

