Paroxysmale Nächtliche Hämoglobinurie (PNH)
1 Was ist eine PNH
2 Symptome
3 Diagnostik
4 Klinischer Verlauf
5 Therapie
6 Prognose
7 Kinderwunsch/Schwangerschaft
8 Register
1 Was ist eine PNH
1.1 Allgemeines
Die Paroxysmale Nächtliche Hämoglobinurie (PNH) ist ebenso wie die Aplastische Anämie keine bösartige, aber eine sehr seltene und potenziell lebensbedrohliche Erkrankung. Ihr liegt ein erworbener genetischer Defekt der blutbildenden Stammzellen des Knochenmarks zugrunde, der nicht vererbbar ist.
1.2 Vorkommen (Epidemiologie)
Die Krankheitshäufigkeit (Inzidenz) liegt bei 1-2 Neuerkrankungen pro 1 Million Menschen und Jahr. Infolge der Vielfältigkeit der Beschwerden muss man jedoch davon ausgehen, dass die PNH zu selten oder erst spät diagnostiziert wird, da sie oft nicht sofort erkannt wird. Am häufigsten wird die Erkrankung zwischen dem 25. und 45. Lebensjahr diagnostiziert, wobei beide Geschlechter etwa gleich häufig betroffen sind. Eine familiäre Häufung liegt nicht vor.
1.3 Entstehung (Pathogenese)
Die PNH kommt durch eine genetische Veränderung (Mutation) blutbildender Stammzellen im Knochenmark zustande. Diese Veränderung ist nicht von Geburt an vorhanden, sondern entsteht erst im Laufe des Lebens (somatische Genmutation) und kann nicht an die Nachkommen vererbt werden. Es liegen gesunde und kranke Zellen gleichzeitig nebeneinander vor (Mosaik).
Diese Genmutation liegt typischerweise in einem speziellen Abschnitt des Erbguts, dem PIG-A-Gen, und betrifft eine oder mehrere blutbildende Stammzellen des Knochenmarks. Das Gen erzeugt einen Biokatalysator (Enzym), der normalerweise für die Produktion eines speziellen Ankersystems, dem Glykosylphosphatidylinositol-Anker (GPI-Anker), benötigt wird. Dieser befindet sich an der Zellmembran und dient der Befestigung zahlreicher Eiweiße (Proteine) auf der Zellmembran, die u.a. der Regulation des Immunsystems dienen. Auf diese Weise schützen sie die Zellen z.B. vor einem Angriff durch einen bestimmten Teil des Immunsystems, dem sogenannten Komplementsystem, indem sie die Zellen als „nicht-fremd“ markieren.
Zwei dieser Proteine spielen dabei eine besonders wichtige Rolle:
- Complement Decay Accelerating Factor (DAF, CD55)
- Protectin (MAC-IP: Membrane Attack Complex Inhibitory Protein, MIRL: Membrane Inhibitor of Reactive Lysis, CD59)
Eine Verminderung oder das komplette Fehlen der GPI-verankerten Proteine auf der Zellmembran der Erythrozyten, Leukozyten und Thrombozyten macht diese Zellen anfälliger für die Zerstörung durch das Komplementsystem. Dabei kommt es zu einem Platzen der PNH-Erythrozyten in den Blutgefäßen (intravasale Hämolyse) und zu einer Aktivierung der Blutplättchen, was zu Thrombosen führen kann.
Das Komplementsystem dient dem Körper zur Abwehr von Infektionserregern, Parasiten, fremden Molekülen etc. Wenn es aktiviert wird, beginnt ein fortschreitender kaskadenartiger Prozess (Komplementkaskade), der u.a. mit der Zerstörung der Zielzelle enden kann.
2 Symptome
Die Symptome und Beschwerden der PNH können unterschiedlich ausgeprägt sein und zeitweise oder andauernd vorliegen. Zusätzlich kann es bei einer Aktivierung des Komplementsystems durch Infekte, Schwangerschaft oder Stress zu einer weiteren Verstärkung der Symptome bis hin zum stark gesteigerten Zerfall der roten Blutkörperchen (hämolytische Krise) kommen. Unter einer laufenden Therapie mit einem Komplementinhibitor spricht man hierbei auch von einer Durchbruchhämolyse. Ein typisches und sichtbares Warnzeichen hierfür wäre das Auftreten von dunklem bzw. schwarzen Urin (Hämoglobinurie). Ebenso ist das Risiko für Thrombosen während dieses Ereignisses erhöht.
In diesen Phasen werden häufig Blutkonserven (Erythrozytenkonzentrate, EKs) oder weitere Therapien benötigt.
Ist die PNH unbehandelt, kann dieser Zustand lebensbedrohlich sein.
2.1 Verminderte Zellzahlen (Zytopenien)
Blutarmut (Anämie)
Der Zerfall der roten Blutkörperchen (Hämolyse) kann zu einer Blutarmut (Anämie) führen und damit zum Fehlen von Sauerstofftransportern (Hämoglobin).
Zu den Symptomen zählen:
- Blässe der Haut (unspezifisches Zeichen)
- Leistungsabfall, Konzentrationsschwäche, Depression, Fatigue, Müdigkeit, schwere Beine, rasche Ermüdung
- Kurzatmigkeit (Dyspnoe) unter Belastung infolge einer verminderten Zahl von Sauerstofftransportern
- Schwindel, Ohrensausen, gesteigerte Herzfrequenz (Tachykardie), Brustenge (Angina pectoris), Sehstörungen
Die Anämie kann so stark sein, dass die Transfusion roter Blutkörperchen (Erythrozytenkonzentrate) notwendig wird.
Weitere verringerte Zellreihen
Neben der roten Zellreihe können auch andere Blutzellreihen vermindert (Zytopenie) sein wie z.B. die Blutplättchen (Thrombozytopenie) oder die Granulozyten (Neutropenie). Dies ist meist Ausdruck der begleitenden Aplastischen Anämie.
2.2 Auswirkungen der Hämolyse
Beim Zerfall der roten Blutkörperchen fällt durch den Abbau von Hämoglobin vermehrt der Gallenfarbstoff Bilirubin im Blut an. Dadurch kann es zu einer Gelbfärbung der Haut und der weißen äußeren Haut des Augapfels (Sklera) kommen. Man spricht dann auch von einer Gelbsucht (Ikterus bzw. Sklerenikterus).
Zusätzlich wird beim Zerfall der roten Blutkörperchen Hämoglobin freigesetzt. Bei einem sehr hohen Anfall an freiem Hämoglobin kann dies über die Niere ausgeschieden werden und führt zu einem dunklen, rotbraunen oder sogar schwarzen Urin (Hämoglobinurie).
Über verschiedene Abbauschritte führt das freie Hämoglobin zu einer verringerten Verfügbarkeit von Stickstoffmonoxid (NO). Stickstoffmonoxid wird für die Erschlaffung der glatten Muskulatur benötigt, die sich z. B. im Magen-Darm-Trakt, in Gefäßen oder in der Lunge befindet. Ist es nicht ausreichend verfügbar, führt dies zur Anspannung der glatten Muskulatur u.a. mit Krämpfen, einer Engstellung von Gefäßen und einem dadurch erhöhten Blutdruck.
Durch diesen Wirkmechanismus werden zahlreiche der klinischen Symptome der PNH erklärt:
- Starke, oft krisenhafte Bauchschmerzen
- Verkrampfung der Speiseröhre mit Schluckstörungen (Dysphagie)
- Bluthochdruck
- Hochdruck im Lungenkreislauf (pulmonale Hypertonie) mit Luftnot
- Einschränkung der Nierenfunktion
- Erektionsstörungen (erektile Dysfunktion)
2.3 Erschöpfung (Fatigue)
Unter Fatigue versteht man eine unnatürlich andauernde Müdigkeit oder Erschöpfung, die die körperliche und geistige Leistungsfähigkeit deutlich beeinträchtigen kann. Sie ist dadurch gekennzeichnet, dass auch durch vermehrte Ruhe oder Schlaf keine oder nur eine unzureichende Besserung eintritt.
Eine mögliche Ursache für die Fatigue im Zusammenhang mit der PNH ist neben einer Anämie und der Zerstörung der roten Blutkörperchen der daraus resultierende Mangel an Stickstoffmonoxid (NO). Fatigue kann aber auch durch andere Störungen des Immunsystems oder des Stoffwechsels entstehen.
2.4 Thromboseneigung (Thrombophilie)
Eine der gefährlichsten Folgen der unbehandelten PNH und des daraus resultierenden Mangels an Stickstoffmonoxid (NO) ist die Ausbildung von Blutgerinnseln (Thrombosen). Durch diesen Mangel werden u.a. die Blutplättchen aktiviert und verursachen so auf unnatürliche Weise Blutgerinnsel. Diese können die kleinen Gefäße verstopfen und zu einem Infarkt der betroffenen Organe führen. Es können verschiedenste Stellen des Körpers betroffen sein, z.B. die Leber oder das Gehirn, sowohl blutzurückführende (Venen) als auch blutversorgende Gefäße (Arterien). Ebenso kann der hohe Anfall an freiem Hämoglobin zu einem akuten Nierenversagen führen.
3 Diagnostik
Die bevorzugte Untersuchungsmethode für die Diagnostik der PNH ist die sogenannte Durchflusszytometrie. Diese Methode ist sehr empfindlich und kann daher eine sehr kleine Anzahl an krankhaft veränderten Zellen nachweisen. Außerdem können der Anteil der betroffenen Zellen (PNH-Klongröße) und die betroffenen Zellarten, z.B. Erythrozyten, Granulozyten oder Monozyten sehr genau bestimmt werden. Für diese Untersuchung wird Blut aus der Vene (peripheres Blut) verwendet.
Bei einer Erstdiagnose sollten weitere Untersuchungen durchgeführt werden:
- Krankengeschichte (Anamnese), auch der Familie, einschließlich gezielter Befragung zu PNH-typischen Symptomen, siehe 2 Symptome
- körperliche Untersuchung unter Berücksichtigung der o.g. speziellen Aspekte: Anämie-Zeichen, Gelbsucht (Ikterus), Hinweise auf akute oder frühere Thrombosen, Blutungszeichen, konstitutionelle Auffälligkeiten wie bei angeborenen Aplastischen Anämien (siehe dort), Vergrößerung der Milz (Splenomegalie)
- Zelluntersuchungen
-
- mikroskopisches Differenzialblutbild
- Untersuchung auf junge, unreife rote Blutkörperchen im Blut (Retikulozyten)
-
- Klinische Chemie
-
- Hämolyse-Parameter: insbesondere LDH, Haptoglobin, Bilirubin
- Nierenfunktionsparameter: Kreatinin, Transferrinsättigung
- Vitamin B12- und Folsäurespiegel
- Eisenstatus: Ferritin, Transferrin, Transferrinsättigung, Retikulozyten-Hämoglobin. Bei Ferritin-Werten > 1000-2000 µg/l sollte je nach Verlauf eine Abklärung von möglichen Organschäden durch eine Eisenüberladung durchgeführt werden.
- BNP-Wert im Blutserum zur Einschätzung der Funktion der rechten Herzkammer als Hinweis für einen Lungenhochdruck (pulmonale Hypertonie)
-
- Funktionsdiagnostik
Eine Knochenmarkdiagnostik mit Histologie, Zytologie, Zytogenetik und Molekulargenetik sollte zum Zeitpunkt der Erstdiagnose durchgeführt werden. Das ist besonders wichtig, wenn gleichzeitig eine Zytopenie eines so hohen Ausmaßes besteht, dass der Verdacht auf eine PNH in Zusammenhang mit einer anderen hämatologischen Erkrankung, z. B. einer Aplastischen Anämie oder einem Myelodysplastischen Syndrom (MDS), besteht.
Bei Nachweis von PNH-Zellen (PNH-Klon) oder der Diagnose eines Knochenmarkversagen-Syndroms (Bone Marrow Failure Syndrome, BMFS) sollten Kontrollen insbesondere in den ersten beiden Jahren nach Erstdiagnose alle 6 Monate sowie bei neu aufgetretenen Beschwerden durchgeführt werden. Der relative Anteil des PNH-Klons (PNH-Klongröße) an der Gesamtzahl der Knochenmarkzellen kann schwanken und ist für den weiteren Verlauf der Erkrankung sowie die Festlegung und Kontrolle der Therapie wichtig.
4 Klinischer Verlauf
4.1 Allgemeines
Die Beschwerden und Probleme der PNH können sehr unterschiedlich sein und zu einer Beeinträchtigung der Lebensqualität durch die oben genannten Symptome führen.
Durch die beschriebenen Mechanismen der Erkrankung kann es u.a. zu einem Bluthochdruck, einem Hochdruck im Lungenkreislauf (pulmonale Hypertonie) und Nierenfunktionsstörungen kommen. Diese Veränderungen können zu dauerhaften Schäden führen und bedürfen einer stetigen Verlaufskontrolle.
4.2 Blutgerinnsel (Thrombosen/Thromboembolien)
Die schwerwiegendste Komplikation der PNH ist die Entstehung von Blutgerinnseln (Thrombosen/Thromboembolien), die zum Verschluss der Blutgefäße führen. Die Wahrscheinlichkeit für das Auftreten einer Thrombose betrug Studien zufolge
– 30 % innerhalb von 10 Jahren ohne spezifische Therapie (Komplementinhibitoren, Thrombozytenaggregationshemmung)
– 30-50 % im Verlauf der Erkrankung ohne spezifische Therapiemaßnahmen
Thromboembolische Komplikationen sind bei der PNH ursächlich für bis zu 67 % aller Todesfälle. Auch für PNH-Patienten mit nur wenigen PNH-Zellen besteht ein erhöhtes Thromboserisiko. Möglicherweise hängt die Wahrscheinlichkeit, eine Thrombose zu erleiden, von der Größe des PNH-Klons ab.
Thrombosen bei PNH-Patienten treten an typischen und weniger typischen Stellen auf:
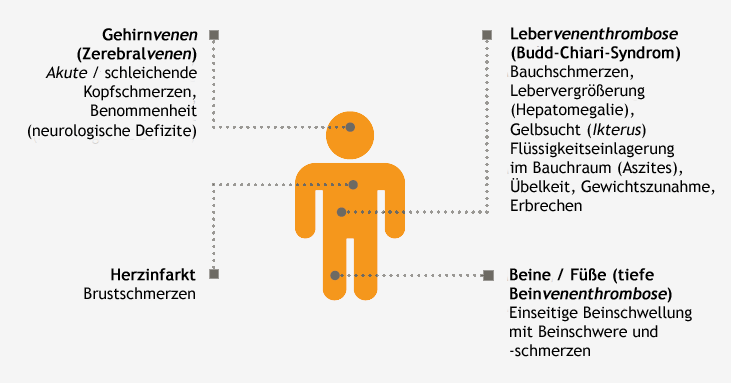
Thrombosen bei PNH-Patienten treten an typischen und weniger typischen Stellen auf.
4.3 Nierenfunktionsstörung
Bei zwei Drittel aller Patienten mit PNH findet sich eine Beeinträchtigung der Nierenfunktion. Es überwiegen eine gestörte Filterfunktion und dadurch eine verschlechterte Reinigung des Blutplasmas durch die Nieren. Als Parameter für die Nierenfunktion wird die sogenannte Kreatinin-Clearance bestimmt, die die Dauer angibt, in der das Blutplasma vom Kreatinin, einem Muskelabbauprodukt, gereinigt wird. Sowohl die Filterfunktion als auch die Kreatinin-Clearance können sich im Verlauf der Krankheit verschlechtern.
4.4 Verminderung von Zellzahlen (Zytopenien)
Die deutliche Verminderung der Blutzellen aufgrund einer begleitenden Knochenmarkerkrankung ist mit 20 % die zweithäufigste Ursache für schwerwiegende Komplikationen. Etwa 15 % der Patienten entwickeln im Verlauf eine Aplastische Anämie mit dem Fehlen aller drei Blutzellreihen (Panzytopenie). Umgekehrt kann auch zuerst eine Aplastische Anämie vorliegen, zu der dann eine PNH hinzukommt.
5 Therapie
5.1 Übersicht
Die Behandlung der PNH hängt von der Ausprägung der Beschwerden und den Symptomen ab. Liegen keine relevanten Beschwerden vor, ist es gerechtfertigt, nur engmaschige Kontrollen durchzuführen. Unterstützende (supportive) Maßnahmen und eine medikamentöse Hemmung der Blutgerinnung (Antikoagulation), üblicherweise auch Blutverdünnung genannt, können erwogen werden. Durch die Antikoagulation wird das Blut nicht tatsächlich verdünnt, sondern es wird die Verstopfung („Verdickung“) der Gefäße durch Blutgerinnsel verhindert. Bei der symptomatischen PNH hängt die Behandlungsform u.a. von der Schwere der Zerstörung der roten Blutkörperchen (Hämolyse) und dem Vorliegen von Thrombosen bzw. Blutgerinnseln ab.
In der folgenden Grafik wird das Behandlungskonzept der hämolytischen PNH dargestellt:

Vereinfachte Darstellung des Therapiealgorithmus. Der vollständige Algorithmus ist abgebildet in den Leitlinien der DGHO auf Onkopedia.
5.2 Spezifische Therapie
Da das Komplementsystem Da das Komplementsystem (siehe 4.1.3) die krankhaft veränderten roten PNH-Blutkörperchen angreift, setzen Medikamente an dieser Stelle an. Sie werden Komplementinhibitoren genannt und hemmen einen Teil des Komplementsystems. Damit unterdrücken sie die Zerstörung der roten Blutkörperchen bzw. verhindern sie ganz. Ziel einer Therapie mit solch einem Komplementinhibitor ist die Vermeidung schwerwiegender, lebensbedrohlicher Komplikationen und möglicher Folgeschäden.
Medizinische Gründe für eine Therapie mit Eculizumab/Ravulizumab sind u. a.
- Blutgerinnsel
- Krisenhafte Bauchschmerzen
- Hämolytische Krisen
- PNH-bedingte Störung der Nierenfunktion
- Transfusionsbedürftigkeit
- mit PNH einhergehender Lungenhochdruck (pulmonale Hypertonie)
C5-Komplementinhibition
Die am längsten zugelassenen zielgerichteten Therapien der PNH sind der 2007 eingeführte Anti-C5-Antikörper Eculizumab (Soliris®) und dessen langwirksame Form Ravulizumab (Ultomiris®), die 2019 zugelassen wurde.
Diese beiden Wirkstoffe blockieren die Aktivität des Proteins C5 des Komplementsystems (sogenannte terminale Komplementinhibition). Verschiedene Studien konnten zeigen, dass Eculizumab bzw. Ravulizumab durch diese Blockade die direkte Zerstörung der roten Blutkörperchen in den Blutgefäßen (intravasale Hämolyse) stark reduziert.
Es zeigte sich dadurch eine erhebliche Verbesserung der Lebensqualität bei den mit Eculizumab/Ravulizumab behandelten PNH-Patienten. Dies war sogar bei den Patienten zu beobachten, bei denen keine Normalisierung der Hämoglobinwerte eintrat. Das spricht dafür, dass neben der Besserung der Anämie ein Teil der Wirkung auf die Blockade der Zerstörung der roten Blutkörperchen (Hämolyse) selbst zurückgeführt werden kann.
Die spezifische Therapie bewirkte eine deutlichen Abnahme des Transfusionsbedarfs, der Anämie, der Erschöpfung (Fatigue), der krisenhaften Bauchschmerzen sowie eine Verringerung des Bluthochdrucks (arterieller Hypertonus) und Lungenhochdrucks (pulmonale Hypertonie). Außerdem wurde in den Studien eine Verbesserung oder sogar Normalisierung der Nierenfunktion nach einer evtl. zuvor vorhandenen Nierenfunktionsstörung beschrieben.
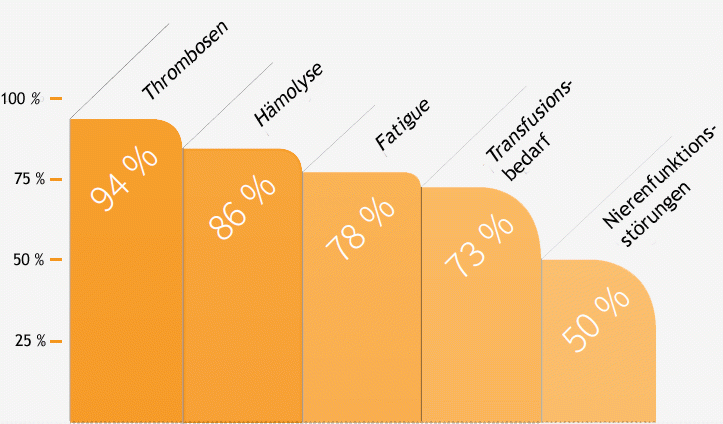
Wirkung von Eculizumab in der Behandlung der PNH
Die Gabe von Eculizumab bzw. Ravulizumab erfolgt als Infusion in eine Vene (intravenös) und kann ambulant durchgeführt werden. Üblicherweise wird die Infusion von Eculizumab in den ersten 4 Wochen einmal wöchentlich zur Aufsättigung und im Anschluss alle 2 Wochen als Erhaltungstherapie gegeben. Dagegen muss Ravulizumab zur Aufsättigung zweimal im Abstand von 2 Wochen gegeben werden und danach nur noch alle 8 Wochen in der Erhaltungstherapie. Anders als bei Eculizumab erfolgt die Dosierung von Ravulizumab in Abhängigkeit vom Körpergewicht. Die Laufzeit der Infusion richtet sich wiederum nach der Dosierung.
Mit Crovalimab (Piasky®) steht seit 2024 ein weiterer Anti-C5-Antikörper zur Verfügung, der nach einmaliger intravenöser Gabe (Infusion) mit einem geringeren Volumen unter die Haut (subkutan) verabreicht werden kann. Hier ist eine Erhaltungstherapie alle 4 Wochen notwendig.
Während die Zerstörung der roten Blutkörperchen innerhalb der Blutgefäße (intravasale Hämolyse) durch eine terminale Komplementinhibition mit Eculizumab/Ravulizumab/Crovalimab erfolgreich unterdrückt wird, tritt nun bei einem Teil der Patienten ein langsamer Abbau der krankhaft veränderten roten Blutkörperchen außerhalb der Gefäße (extravasale Hämolyse) in den Vordergrund. Dieser Vorgang wird durch eine Beladung mit Vorstufen des Komplementsystems ausgelöst und kann durch spezielle Blutuntersuchungen (u.a. Retikulozyten, Bilirubin-Wert, Coombs-Test) nachgewiesen werden. Die Zerstörung der roten Blutkörperchen außerhalb der Blutgefäße zu unterdrücken, war Ausgangspunkt für die Entwicklung neuer Medikamente.
C3-Komplementinhibition
C3-Komplementinhibitoren (proximale Komplementinhibitoren) hemmen das Komplement innerhalb der Kaskade früher als C5-Inhibitoren. Dadurch kann die Beladung der PNH-Zellen mit Komplementvorstufen und damit eine extravasale Hämolyse reduziert oder verhindert werden. Zu diesen neuen Substanzen gehören der C3-Inhibitior Pegcetacoplan, der Faktor D-Inhibitor Danicopan und der Faktor B-Inhibitor Iptacopan. Auch bei den Faktoren B und D handelt es sich wie beim gesamten Komplementsystem um Eiweiße (Proteine).
(Abbildung folgt)
Pegcetacoplan (Aspaveli®) muss als Infusion 2-3x/Woche über ca. 1 Stunde unter die Haut (subkutan) verabreicht werden.
Danicopan (Voydeya®) als Tablettentherapie muss zusätzlich zu einer laufenden Therapie mit Eculizumab oder Ravulizumab mit 150-200 mg 3x täglich eingenommen werden.
Iptacopan (Fabhalta®) wird als Tablettentherapie (Kapseln) mit 200 mg 2x täglich als Monotherapie verabreicht.
Insgesamt zeigten die Daten der Zulassungsstudien und aktuelle Auswertungen zur Langzeittherapie, dass es sich um sehr gut verträgliche Therapien bzw. Medikamente handelt. Als sehr häufige Nebenwirkung können Kopfschmerzen auftreten, was nur zu Beginn der Therapie vorkommt. Weitere mögliche Nebenwirkungen waren u.a. Infektionen, Blutbildveränderungen, Schlaflosigkeit, Magen-Darm-Beschwerden, Hautprobleme, grippeähnliche Symptome und Fatigue.
Zudem war auffällig, dass PNH-Patienten nach den ersten Gaben der Komplementinhibtion verstärkt über Kopfschmerzen klagten. Dieses Symptom ist ein Zeichen für die gute Wirksamkeit des Medikaments. Da weniger rote Blutkörperchen zerfallen, ist wieder mehr Stickstoffmonoxid (NO) verfügbar ist. Somit können sich die Blutgefäße erweitern, aber der Körper muss sich erst wieder an diesen Normalzustand gewöhnen.
Durch den verminderten Zerfall der kranken roten Blutkörperchen wird weniger oder kein Hämoglobin und damit kein Eisen mehr über den Urin ausgeschieden. Mit dem Wegfall dieses chronischen Verlusts an Eisen über die Niere beobachtet man bei einigen PNH-Patienten unter einer Therapie einen Anstieg der Eisenspeicher. Diese sollten daher regelmäßig, insbesondere bei begleitender relevanter Aplastischer Anämie, kontrolliert werden, um eine eventuell laufende Behandlung mit Eisentabletten rechtzeitig abzusetzen (Ziel-Ferritin > 100 µg/l) und bei Bedarf das überschüssige Eisen durch eine sogenannte Chelattherapie zu entfernen.
Eine Therapie mit Komplementinhibitoren vermindert jedoch nicht die Anzahl der kranken Zellen oder heilt die Erkrankung. Im Gegenteil, durch den Schutz der Komplementinhibition zerfallen weniger bzw. keine der krankhaft veränderten roten Blutkörperchen, die somit in vermehrter Anzahl vorliegen. Die Zunahme dieser PNH-Erythrozyten bzw. des Hämoglobin-Wertes ist also ein Zeichen für die Wirksamkeit der Therapie. Umso wichtiger ist es, dass die Therapie regelmäßig verabreicht bzw. die Tabletten regelmäßig eingenommen werden, um den kontinuierlichen Schutz der kranken Zellen zu gewährleisten und die erwähnten Komplikationen der PNH (Durchbruchhämolyse) zu vermeiden.
Impfungen
Schutzimpfungen sind notwendig, weil sich der Körper aufgrund der Hemmung des Komplementsystems nur unzureichend gegen bekapselte Bakterien (Meningokokken, Pneumokokken und Haemophilus influenzae) schützen kann. Diese Bakterien können eine schwerwiegende Infektion verursachen, z.B. Blutvergiftung, Lungenentzündung, bakterielle Hirnhautentzündung. Daher ist unter einer Therapie mit Eculizumab/Ravulizumab/Crovalimab zwingend eine Schutzimpfung gegen Meningokokken notwendig. Es ist notwendig, mit zwei verschiedenen Impfstoffen (Menveo®/Nimenrix® und Bexsero®/Trumenba®) möglichst viele der Meningokokkenstämme (A, C, W135, Y zu Therapiebeginn und B unter laufender Therapie) abzudecken, wobei trotzdem kein 100%iger Schutz erreicht wird. Die Schutzimpfungen sollten alle drei Jahre aufgefrischt werden.
Zusätzlich müssen Patienten, die mit Pegcetacoplan oder Iptacopan behandelt werden, noch gegen Pneumokokken (Prevenar 20®) und Haemophilus influenzae Typ B (ActHib® oder Hiberix®) geimpft werden. Die Impfung gegen Pneumokokken sollte alle 6 Jahre wiederholt werden. Die Impfung gegen Haemophilus ist einmalig.
Trotz aller Impfungen können schwerwiegende Infektionen mit einer Blutvergiftung (Sepsis) auftreten, daher gelten immer diese Verhaltensmaßregeln:
Bei Fieber (Temperatur > 38,3 °C), Hautausschlag, starkem Krankheitsgefühl, Nackensteife, schwerem Atemwegsinfekt ist es entscheidend, dass schnellstmöglich eine „Stand-by-Therapie“ (z.B. Amoxicillin/Clavulansäure 1000 mg) erfolgt und sofort ein Arzt aufgesucht wird, um die weitere Diagnostik und ggf. eine erweiterte Antibiotikatherapie einzuleiten.
Darüber hinaus sollte mit dem behandelnden Hämatologen der aktuelle Impfstatus besprochen werden, insbesondere im Hinblick auf mögliche weitere Impfungen wie Influenza (Grippe), COVID-19, Respiratorische Synzitialviren (RSV), Gürtelrose (Herpes zoster) sowie Auffrischungsimpfungen.
5.3 Symptomatische Therapie
Neben den genannten Komplementinhibitoren gibt es weitere Möglichkeiten zur Behandlung der auftretenden allgemeinen Beschwerden.
Bei Anämie-Symptomen können Erythrozytenkonzentrate verabreicht werden. Auch wenn durch die Transfusion geringe Mengen an Komplementfaktoren zugeführt werden, kommt es dabei nicht zu einer Verstärkung der Komplement-vermittelten Hämolyse. Dies gilt auch für den Einsatz von Thrombozytenkonzentraten, siehe Aplastische Anämie, 5.5 Unterstützende Therapie > Blutübertragungen.
Steht eine PNH nicht im direkten Zusammenhang mit einem Knochenmarkversagen, nennt man sie „klassische PNH“. Unbehandelt kommt es dabei häufig zu einem Eisenmangel durch den ständigen Verlust von Hämoglobin über die Nieren. Da Eisen für die Bildung roter Blutkörperchen notwendig ist, muss es in diesen Situationen zugeführt werden. Eisen kann in Form von Tabletten oder als Infusion über die Vene gegeben werden. Orale Präparate sollten idealerweise jeden zweiten Tag morgens auf nüchternen Magen eingenommen werden. Des Weiteren sollte das Eisen nicht gleichzeitig mit Antibiotika oder Arzneimitteln zur Neutralisierung der Magensäure (Antazida) eingenommen werden. Wird eine entsprechende Eisenbehandlung begonnen, muss die Therapieentscheidung für die Eisenergänzung regelmäßig überprüft werden. Hierzu eignet sich die Kontrolle des Ferritinwerts im Rahmen der ärztlichen Kontrolluntersuchungen (Ziel-Ferritin > 100 µg/l).
Durch die kompensatorisch verstärkte Neubildung der roten Blutkörperchen liegt ein vermehrter Bedarf an Folsäure und ggf. auch Vitamin B12 vor. Hier sollte generell eine Ergänzung mit z.B. 5 mg Folsäure pro Tag bzw. 1-2x/Woche erfolgen. Vitamin B12 sollte bei einem Mangel als Kur über einen gewissen Zeitraum gegeben werden.
In früheren Studien konnte beobachtet werden, dass das Risiko für Thrombosen mit der Menge der PNH-Zellen und der Stärke der hämolytischen Aktivität einhergeht. Beträgt der Anteil GPI-gestörter Granulozyten mehr als 50 % und/oder der LDH-Wert mehr als das 1,5fache des oberen Normwerts, nimmt das Auftreten von Thrombosen deutlich zu. Wurde solchen Patienten eine vorbeugende Gerinnungshemmung verabreicht, entwickelten sie erheblich seltener Thrombosen.
Daher gelten folgende Empfehlungen:
- Über den Einsatz eines gerinnungshemmenden Medikaments sollte bei jedem Patienten individuell entschieden werden.
- Unter einer Therapie mit einem Komplementinhibitor ist eine vorbeugende Gerinnungshemmung nicht notwendig.
- Sollte vor einer Therapie mit einem Komplementinhibitor eine vorbeugende Gerinnungshemmung begonnen worden sein, kann erwogen werden, diese nach der Normalisierung der hämolytischen Aktivität unter der Therapie mit einem Komplementinhibitor zu beenden. Von einem eigenständigen Absetzen ist jedoch strengstens abzuraten.
- Wenn bereits eine Thrombose aufgetreten ist, sollte eine Gerinnungshemmung durchgeführt werden. Die Dauer hängt von der Lokalisation der Thrombose und dem Verlauf ab.
- Bei Risikosituationen wie z.B. Bettlägerigkeit, längerfristiger Bewegungseinschränkung (Gips), Operationen oder längeren (> ca. 4-6 Stunden) Bus- oder Flugreisen sollte in Abhängigkeit von den aktuellen Thrombozytenwerten vorbeugend eine Gerinnungshemmung (z.B. als Spritze oder Tablette) durchgeführt werden.
- Bakterielle Infektionen sollten frühzeitig erkannt und konsequent mit einem Antibiotikum behandelt werden, da es im Rahmen von Infekten zu einer akuten Verschlechterung der PNH mit einer hämolytischen Krise kommen kann.
- Bei einer hämolytischen Krise/Durchbruchhämolyse soll eine ausreichende Flüssigkeitszufuhr (Hydrierung) erfolgen. Ggf. sind eine antibiotische Therapie, Transfusionen und zusätzliche Gaben des Komplementinhibitors sowie – bei Verschlechterung der Nierenfunktion – eine Blutwäsche (Dialyse) erforderlich.
- In Ausnahmefällen kann bei begleitender Knochenmarkschwäche (Knochenmarkinsuffizienz) oder nach Entwicklung einer nierenbedingten (renalen) Anämie die Gabe blutbildender (hämatopoetischer) Wachstumsfaktoren, z.B. Erythropoetin oder G-CSF, sinnvoll sein.
- Steht das Knochenmarkversagen (Aplasie) gegenüber der PNH im Vordergrund, sollte ggf. eine immunsuppressive Therapie oder eine Stammzell- bzw. Knochenmarktransplantation erfolgen, siehe Aplastische Anämie, 5 Therapie.
5.4 Heilung
Die einzige Therapie der PNH mit Aussicht auf eine Heilung (kurativer Ansatz) ist die allogene Knochenmark- bzw. Stammzelltransplantation. Allerdings geht sie mit einer erheblichen Komplikations- (Morbiditäts-) und Sterblichkeits- (Mortalitäts-)rate einher. Daher sollte die Therapieentscheidung (Indikation) für eine Transplantation sehr streng gestellt werden, insbesondere seit der Verfügbarkeit der Therapie mit Komplementinhibitoren.
Medizinische Gründe für eine Stammzelltransplantation sind
- wiederkehrende, lebensbedrohliche thromboembolische Komplikationen, die auf eine anderweitige Therapie nicht ansprechen
- eine sehr schwere, nicht durch eine Therapie beeinflussbare (refraktäre) hämolytische Anämie, die Transfusionen erforderlich macht
- Vorliegen eines PNH-Klons bei einer Aplastischen Anämie (AA) oder einem Myelodysplastischen Syndrom (MDS), wenn die Aplastische Anämie oder das Myelodysplastische Syndrom bereits einen Transplantationsgrund darstellen
- Übergang in eine Aplastische Anämie, wenn eine immunsuppressive Therapie nicht indiziert ist, oder in ein Myelodysplastisches Syndrom
6 Prognose
Durch die deutliche Reduktion der thromboembolischen Ereignisse unter der Therapie mit einem Komplementinhibitor haben mit PNH diagnostizierte Patienten annähernd die gleiche Lebenserwartung wie die Normalbevölkerung.
7 Kinderwunsch/Schwangerschaft
Bis noch vor wenigen Jahren musste man PNH-Patientinnen von einer Schwangerschaft abraten, da häufig lebensbedrohliche Komplikationen bei Mutter und Kind beobachtet wurden. Da unter der Antikörpertherapie dieses Risiko deutlich verringert ist, wird das Thema Familienplanung wieder bedeutsam. Zwischenzeitlich liegen Berichte zu Schwangerschaften unter einer Therapie mit Eculizumab, Ravulizumab und Crovalimab vor und zeigen sehr ermutigende Ergebnisse, wobei die Fallzahlen begrenzt sind. Die Schwangerschaften verliefen im Wesentlichen komplikationslos und alle Kinder waren gesund. Dennoch sollte bei einem entsprechenden Kinderwunsch bzw. bei einer Schwangerschaft die Anbindung an ein spezialisiertes Zentrum mit hämatologischen und gynäkologischen Fachbereichen erfolgen, um das individuelle Risikoprofil der Patientin zu klären und ggf. auch die Dosis des Komplementinhibitors anzupassen.
8 Ausblick
Derzeit werden weitere Substanzen, die das Komplementsystem hemmen, in klinischen Studien geprüft.
9 Register
Da es sich bei der PNH um eine sehr seltene Erkrankung handelt, können relevante Informationen zur Erkrankung und Therapie nur über die Auswertung der Daten möglichst vieler PNH-Patienten auf internationaler Ebene gewonnen werden. Zu diesem Zweck wurde zunächst das Internationale PNH-Patientenregister (PNH Registry) aufgelegt, das Ende 2024 geschlossen wurde. Um diese Aktivität insbesondere mit den neuen Therapiemöglichkeiten fortzusetzen, wurde ein neues Register von einer internationalen PNH-Expertengruppe (International PNH Interest Group, IPIG) ins Leben gerufen. Seit 2025 dokumentiert es nach einer Patienteneinwilligung in anonymisierter Form alle 6 Monate Daten zum Verlauf der Erkrankung, zur Therapie und zur Lebensqualität. Da nur über solche Informationen neue Erkenntnisse zu der Erkrankung gewonnen und eine weitere Verbesserung der Therapie erreicht werden können, sollten sich möglichst alle PNH-Patienten bereiterklären, ihre Daten dem Register zur Verfügung zu stellen.
MACHEN SIE BITTE MIT!
Bei Interesse oder Rückfragen wenden Sie sich bitte per E-Mail an Prof. Dr. med. Alexander Röth (alexander.roeth(at)ukessen.de) oder an Prof. Dr. med. Hubert Schrezenmeier (h.schrezenmeier(at)blutspende.de).

